阿莱西奥·南西奥尼、艾琳·卡法、萨尔瓦多·科尔泰利诺
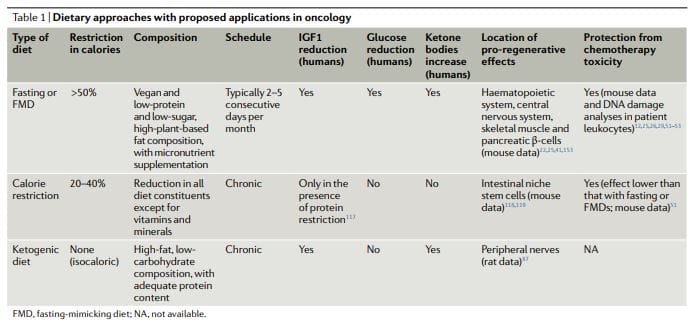
摘要 | 癌细胞对营养缺乏的脆弱性及其对特定代谢物的依赖是癌症的新特征。 禁食或模拟禁食饮食 (FMD) 会导致生长因子和代谢物水平发生广泛变化,从而产生可以降低癌细胞适应和生存能力的环境,从而提高癌症治疗的效果。 此外,禁食或口蹄疫会增加正常细胞对化疗的抵抗力,但不会增加癌细胞对化疗的抵抗力,并促进正常组织的再生,这可能有助于防止治疗带来的有害和可能危及生命的副作用。 虽然患者几乎无法忍受禁食,但动物和临床研究都表明,低热量 FMD 的周期是可行的并且总体上是安全的。 几项评估禁食或口蹄疫对治疗中出现的不良事件和疗效结果影响的临床试验正在进行中。 我们建议将口蹄疫与化学疗法、免疫疗法或其他疗法相结合,代表了一种潜在的有希望的策略,可以提高治疗效果、防止耐药性获得和减少副作用。
饮食和生活方式相关因素是患癌症风险的关键决定因素,某些癌症比其他癌症更依赖于饮食习惯1�
尽管在过去十年中,我们目睹了癌症治疗方面前所未有的变化和显着进步 14,15,但仍然迫切需要更有效,并且可能,
禁食迫使健康细胞进入缓慢分裂和高度保护的模式,保护它们免受来自抗癌药物的毒性损伤,同时使不同类型的癌细胞对这些治疗敏感11,12,17、XNUMX、XNUMX。 这一发现意味着单一的饮食干预可能有助于解决癌症治疗的不同且同样重要的方面。
在这篇意见文章中,我们讨论了使用禁食或模拟禁食饮食 (FMD) 来抑制 TEAE 以及预防和治疗癌症的生物学原理。 我们还说明了这种实验方法的注意事项 18,19 以及已发表和正在进行的临床研究,其中禁食或 FMD 已应用于癌症患者。
内容
全身和细胞禁食反应
禁食会导致许多代谢途径的活动发生变化,这些代谢途径与转换为能够利用主要从脂肪组织和部分肌肉释放的碳源产生能量和代谢物的模式相关。 循环激素和代谢物水平的变化转化为细胞分裂和 代谢活动 正常细胞并最终保护它们免受化疗损伤11,12。 癌细胞,通过不服从这些饥饿条件所决定的抗生长命令,可以产生与正常细胞相反的反应,因此对化学疗法和其他癌症疗法敏感。
对禁食的全身反应
对禁食的反应部分是由循环中的葡萄糖、胰岛素、胰高血糖素、生长激素 (GH)、IGF1、糖皮质激素水平决定的
胰高血糖素和低水平的胰岛素也会刺激甘油三酯(主要储存在脂肪组织中)分解成甘油和游离脂肪酸。 在禁食期间,大多数组织利用脂肪酸作为能量,而大脑则依赖于葡萄糖和肝细胞产生的酮体(酮体可以由脂肪酸 α-氧化产生的乙酰辅酶 A 或生酮氨基酸产生)。 在禁食的生酮阶段,酮体达到毫摩尔范围内的浓度,通常在禁食开始后 2 到 3 天开始。 与脂肪衍生的甘油和氨基酸一起,酮体促进糖异生,将葡萄糖水平维持在大约 4mM(70mg/dl)的浓度,这主要被大脑利用。
糖皮质激素和肾上腺素也有助于指导代谢适应
最后,禁食会降低循环瘦素的水平,瘦素是一种主要由脂肪细胞产生的抑制饥饿的激素,同时增加脂联素的水平,从而增加脂肪酸分解23,24。 因此,总而言之,哺乳动物对禁食的全身反应的标志是低水平的葡萄糖和胰岛素、高水平的胰高血糖素和酮体、低水平的 IGF1 和瘦素以及高水平的脂联素。
细胞对禁食的反应
健康细胞对禁食的反应在进化上是保守的,并赋予细胞保护,至少在模式生物中,已被证明可以延长寿命和健康寿命12,22,25、31、1-XNUMX。 IGFXNUMX
禁食和由此产生的葡萄糖限制抑制 PKA 活性,增加 AMPK 活性并激活 EGR1,从而实现细胞保护作用,包括心肌中的细胞保护作用22,25,26、1、22,37。 最后,禁食和口蹄疫(见下文的组成)还具有通过分子机制促进再生作用(方框 49)的能力,其中一些与癌症有关,例如增加自噬或诱导沉默调节蛋白活性 XNUMX-XNUMX .

癌症口蹄疫的饮食方法
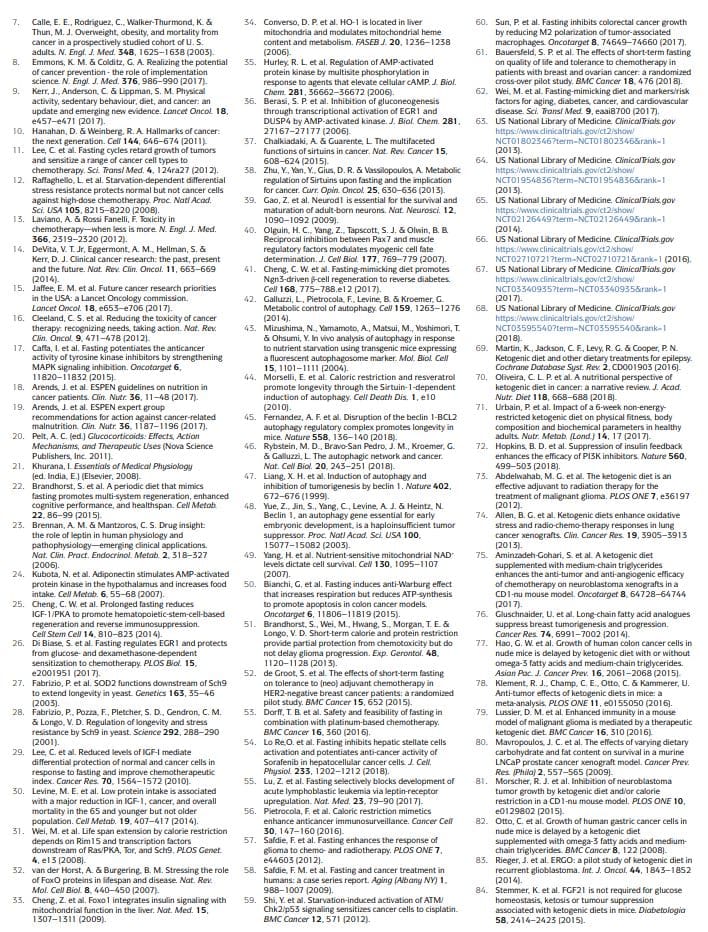
基于禁食的饮食方法已在肿瘤学中得到更广泛的研究,包括临床前和临床,包括禁水(禁食除水以外的所有食物和饮料)和口蹄疫11,12,17,25,26,50、60、1、48、XNUMX、XNUMX-XNUMX(表XNUMX)。 初步临床数据表明,可能需要禁食至少 XNUMX 小时才能在肿瘤学中实现具有临床意义的效果,例如防止化疗引起的健康组织 DNA 损伤和帮助维持
然而,大多数患者拒绝或难以完成禁水,并且与之相关的长期卡路里和微量营养素缺乏的潜在风险难以证明。 FMD 是医学设计的饮食方案,热量非常低(即通常每天 300 到 1,100 千卡)、糖和蛋白质,可重现纯水禁食的许多效果,但患者依从性更好,营养风险降低 22,61,62, 3. 在 FMD 期间,患者通常接受不受限制的水量、少量标准化的蔬菜汤、汤、果汁、坚果棒和草药茶,以及微量营养素补充剂。 在一项对一般健康受试者进行为期 5 天的 FMD 的 1 个月周期的临床研究中,该饮食具有良好的耐受性,并降低了躯干和全身脂肪、血压和 IGF62 水平 3。 在之前和正在进行的肿瘤临床试验中,禁食或口蹄疫通常每 4-1 周进行一次,例如与化疗方案相结合,其持续时间在 5 到 52,53,58,61,63 天之间68、3、52,53,58,61、XNUMX、XNUMX-XNUMX . 重要的是,本研究未报告严重不良事件(根据不良事件通用术语标准,GXNUMX 级或以上)XNUMX。
生酮饮食
生酮饮食 (KDs) 是具有正常卡路里、高脂肪和低碳水化合物含量的饮食方案 69,70。 在经典的 KD 中,脂肪的重量与碳水化合物和蛋白质的总重量之比为 4:1。 值得注意的是,口蹄疫也是生酮的,因为它们具有高脂肪含量并且能够诱导循环酮体水平显着升高(约 0.5 毫摩尔/升)。 在人类中,KD 还可以降低 IGF1 和胰岛素水平(从基线值降低 20% 以上),尽管这些影响受饮食中碳水化合物和蛋白质的水平和类型的影响71。 KDs 可以降低血糖水平,但它们通常保持在正常范围内(即>4.4mmol/L)71。
值得注意的是,KDs 可能有效防止葡萄糖和胰岛素升高,这通常是对 PI3K 抑制剂的反应,这被提议限制其功效 72。 传统上,KDs 一直用于治疗难治性癫痫,主要用于儿童 69。 在小鼠模型中,KDs 诱导抗癌作用,特别是在胶质母细胞瘤中70,72-86。 临床研究表明,KDs 在癌症患者中作为单一药物使用时可能没有实质性的治疗活性,并建议应寻求这些饮食的潜在益处与其他方法相结合,如化学疗法、放射疗法、抗血管生成治疗、PI3K 抑制剂
据报道,KD 对周围神经和海马体具有神经保护作用 87,88、1。 然而,KDs 是否也具有类似于禁食或 FMDs 的再生作用(框 22)以及 KDs 是否也可用于保护活哺乳动物免受化学疗法的毒性仍有待确定。 值得注意的是,禁食或口蹄疫的再生效果似乎通过从饥饿反应模式的转换(包括细胞成分的分解和许多细胞的死亡)以及细胞和组织经历的再喂养期的转换而最大化重建XNUMX。 因为 KD 不强制进入饥饿模式,不促进细胞内成分和组织的主要分解,也不包括再喂养期,所以它们不太可能导致在 FMD 再喂养期间观察到的协调再生类型。
卡路里限制
虽然慢性卡路里限制 (CR) 和缺乏特定氨基酸的饮食与定期禁食有很大不同,但它们与禁食和 FMD 共享或多或少的选择性营养限制,并且具有抗癌作用 81,89-112。 CR 通常涉及从标准卡路里摄入量中长期减少 20% 到 30% 的能量摄入,这将使个人保持正常体重113,114。 它在降低包括灵长类动物在内的模式生物中的心血管危险因素和癌症发病率方面非常有效108,109,114。
然而,CR 会引起副作用,例如外观变化、寒冷敏感性增加、体力下降、月经不调、不孕、性欲减退、骨质疏松症、伤口愈合缓慢、对食物的痴迷、易怒和抑郁。 在癌症患者中,人们非常担心它可能会加剧营养不良,并且不可避免地会导致瘦体重过度损失18,113-116。 CR 可降低空腹血糖水平,但仍保持在正常范围内 114。 在人类中,慢性 CR 不会影响 IGF1 水平,除非还实施了适度的蛋白质限制 117。
研究表明,通过减少潘氏细胞中的 mTORC1 信号传导,CR 增强了它们的干细胞功能,并且它还保护储备肠道干细胞免受 DNA 损伤 118,119,但尚不清楚 CR 是否也会引发其他器官的促再生作用。 因此,现有数据表明,禁食和口蹄疫会产生一种新陈代谢、再生和保护性的特征,这种特征与 KD 或 CR 所引发的特征不同并且可能更有效。
治疗中的禁食和口蹄疫:对激素和代谢物水平的影响
通常在禁食时观察到的循环激素和代谢物水平的许多变化具有发挥抗肿瘤作用的能力(即,葡萄糖、IGF1、胰岛素和瘦素水平降低,脂联素水平升高)23,120,121 和/或保护健康组织免受副作用(即降低 IGF1 和葡萄糖水平)。 由于酮体可以抑制组蛋白去乙酰化酶 (HDAC),因此禁食诱导的酮体增加可能有助于减缓肿瘤生长并通过表观遗传机制促进分化 122。
然而,酮体乙酰乙酸已被证明可以加速而不是减少某些肿瘤的生长,例如带有突变 BRAF123 的黑色素瘤。 最有力的证据表明禁食和口蹄疫对癌症的有益作用的那些变化是 IGF1 和葡萄糖水平的降低。 在分子水平上,禁食或口蹄疫可减少细胞内信号级联,包括 IGF1R、AKT、mTOR、S6K 和 cAMP、PKA 信号,增加自噬,帮助正常细胞承受压力并促进抗癌免疫25,29,56,124
抗压差:增加化疗耐受性
一些酵母癌基因直系同源物,如 Ras 和 Sch9(哺乳动物 S6K 的功能直系同源物)能够降低模式生物的抗逆性 27,28、1。 此外,激活 IGF3R、RAS、PI10KCA 或 AKT 或使 PTEN 失活的突变存在于大多数人类癌症中XNUMX。 总之,这导致了这样一种假设,即饥饿会在癌症细胞与正常细胞中产生相反的影响,因为它们承受细胞压力源(包括化疗药物)的能力。 换句话说,饥饿会导致
根据 DSR 假说,正常细胞通过下调增殖相关基因和核糖体生物发生和/或组装基因来应对饥饿,这迫使细胞进入自我维持模式并保护它们免受化学疗法、放射疗法和其他毒剂造成的损害。 相比之下,在癌细胞中,这种自我维持模式是通过致癌变化来阻止的,这会导致应激反应途径的组成性抑制(图 12)。 符合DSR模型,短期饥饿或原癌基因缺失
在哺乳动物细胞中也获得了类似的结果:暴露于低葡萄糖培养基可保护原代小鼠神经胶质细胞免受过氧化氢或环磷酰胺(一种促氧化化学治疗剂)的毒性,但不能保护小鼠、大鼠和人类神经胶质瘤和神经母细胞瘤癌细胞系。 与这些观察一致,
随后的研究发现,禁食后 IGF1 信号传导减少可保护原代胶质细胞和神经元,但不保护胶质瘤和神经母细胞瘤细胞免受环磷酰胺和促氧化化合物的侵害,并保护小鼠胚胎成纤维细胞免受阿霉素的侵害。 肝脏 IGF29 缺陷 (LID) 小鼠,具有条件性肝脏 Igf1 基因缺失的转基因动物,其循环 IGF1 水平降低 70-80%(与小鼠禁食 1 小时达到的水平相似)72,受到保护测试了四分之三的化疗药物,包括多柔比星。
组织学研究显示,仅在多柔比星治疗的对照小鼠中出现多柔比星诱导的心肌病迹象,而在 LID 小鼠中则没有。 在用阿霉素治疗的荷黑色素瘤动物的实验中,未观察到对照小鼠和 LID 小鼠之间的疾病进展方面的差异,这表明癌细胞没有通过降低 IGF1 水平而免受化学疗法的保护。 然而,与对照动物相比,携带肿瘤的 LID 小鼠再次表现出显着的生存优势,因为它们能够耐受多柔比星毒性 29。 因此,总体而言,这些结果证实 IGF1 下调是禁食增加化疗耐受性的关键机制。
地塞米松和 mTOR 抑制剂都被广泛用于癌症治疗,要么是因为它们作为止吐药的功效,要么是因为
这些干预措施降低了 PKA 活性,同时增加了 AMPK 活性,从而激活了 EGR1,表明 cAMP PKA 信号通过 EGR1 介导了禁食诱导的 DSR(参考文献 26)。 EGR1 还促进心脏保护肽的表达,例如心房利钠肽 (ANP) 和 B 型利钠肽 (BNP) 在心脏组织中的表达,这有助于对多柔比星的耐药性。 此外,禁食和/或口蹄疫可能通过促进自噬来保护小鼠免受阿霉素诱导的心肌病,这可能通过消除功能失调的线粒体和去除有毒聚集体来减少活性氧 (ROS) 的产生来促进细胞健康。
除了减少化疗引起的细胞毒性和增加化疗治疗小鼠的存活率外,禁食周期还可以诱导骨髓再生,并以 PKA 相关和 IGF1 相关的方式防止环磷酰胺引起的免疫抑制。 因此,令人信服的临床前结果表明禁食和口蹄疫有可能提高化疗耐受性并避免主要副作用。 由于最初的临床数据进一步支持了这种潜力,这些临床前研究为在以 TEAE 作为主要终点的随机临床试验中评估 FMD 建立了强有力的理论基础。
差异压力致敏:增加癌细胞的死亡
如果单独使用,大多数饮食干预,包括禁食和口蹄疫,对癌症进展的影响有限。 根据差异应力致敏 (DSS) 假设,禁食或口蹄疫与第二种治疗相结合更有希望 11,12。 这一假设预测,虽然癌细胞能够适应有限的氧气和营养浓度,但许多类型的癌细胞无法执行改变,从而在禁食和化疗相结合产生的营养缺乏和有毒环境中生存, 例如。 乳腺癌、黑色素瘤的早期实验
我们认为癌细胞对改变的条件的这种不适当的反应,包括由禁食或口蹄疫引起的 IGF1 和葡萄糖水平的降低,是导致

通过降低葡萄糖利用率和增加脂肪酸 α-氧化,禁食或 FMD 还可以促进癌细胞从有氧糖酵解(Warburg 效应)转变为线粒体氧化磷酸化,这对于在最缺乏营养的环境中维持癌细胞生长是必要的 50 (图 2)。 由于线粒体呼吸活动增加,这种转换导致 ROS 产生增加,并且还可能由于糖酵解和戊糖磷酸途径的谷胱甘肽合成减少而导致细胞氧化还原电位降低。 活性氧增加和抗氧化保护减少的综合作用增强了癌细胞的氧化应激并增强了化疗药物的活性。 值得注意的是,由于高乳酸产生所证明的高糖酵解活性可以预测几种癌症的侵袭性和转移倾向 11,因此禁食或 FMD 的抗 Warburg 作用有可能对侵袭性和转移性癌症特别有效。
除了新陈代谢的变化,禁食或口蹄疫会引发其他可以促进胰腺癌细胞 DSS 的变化。 禁食会增加表达水平
最后,禁食可以上调瘦素受体及其下游
值得注意的是,包括 AML29 在内的许多癌细胞类型可能会通过规避禁食或 FMD 带来的代谢变化而获得耐药性,这种可能性会因许多癌症的代谢异质性而进一步增加 129。 因此,近期的一个主要目标将是通过生物标志物来确定对这些饮食方案最敏感的癌症类型。 另一方面,当与标准疗法相结合时,禁食或口蹄疫很少导致癌症小鼠模型产生耐药性,而对禁食联合化疗的耐药性在体外研究中也不常见,强调了确定治疗方法的重要性,与 FMD 结合使用时,会对癌细胞产生强大的毒性作用,而对正常细胞和组织的毒性最小11,17,50,55-57,59,124。
通过禁食或口蹄疫增强抗肿瘤免疫力
最近的数据表明,禁食或口蹄疫本身,以及在更大程度上与化疗结合时,会触发淋巴祖细胞的扩张并促进
小鼠模型中的抗癌饮食
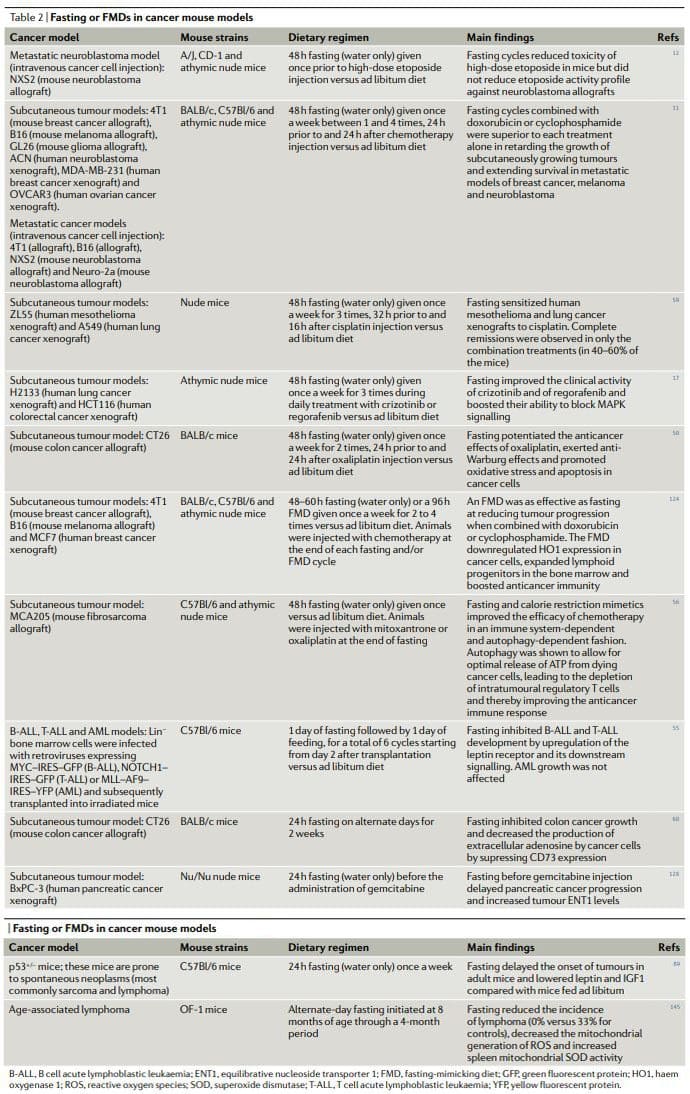
总体而言,动物癌症模型(包括转移性癌症模型)中禁食或 FMD 的临床前研究结果表明(表 2)定期禁食或 FMD 可实现多效抗癌作用并增强化疗药物和 TKI 的活性,同时发挥保护和再生作用在多个器官中22,25。 在不禁食和/或口蹄疫的情况下达到相同的效果需要首先识别,然后使用多种有效、昂贵且经常有毒的药物,并且可能没有诱导健康细胞保护的优势。 值得注意的是,在至少两项研究中,禁食联合化疗被证明是唯一能够在一致的部分治疗动物中实现肿瘤完全消退或长期存活的干预措施11,59
慢性 KD 也表现出
CR 减少了遗传小鼠癌症模型、自发性肿瘤发生小鼠模型和致癌物诱导的癌症小鼠模型以及猴子的肿瘤发生91,92,97,98,101,102,104、106,108,109,136、138、57、6、139、15-XNUMX、XNUMX、XNUMX、XNUMX-XNUMX。 相比之下,一项研究发现,中年开始的 CR 实际上会增加 CXNUMXBl/XNUMX 小鼠中浆细胞肿瘤的发病率XNUMX。 然而,在同一项研究中,CR 还将最大寿命延长了约 XNUMX%,观察到的癌症发病率增加归因于接受 CR 的小鼠的寿命增加,即
重要的是,CR 提高了几种癌症模型中的抗癌治疗活性,包括抗 IGF1R 抗体(ganitumab)对前列腺癌的活性 141、环磷酰胺对神经母细胞瘤细胞的活性 135 以及 HRAS-G12V 转化的永生小鼠肾上皮细胞异种移植物中的自噬抑制 100。 然而,CR 或 KD 与抗癌疗法相结合似乎不如禁食有效。 一项小鼠研究发现,与单独禁食相比,单独 CR 不能减少皮下生长的 GL26 小鼠神经胶质瘤的生长,并且再次与短期禁食相比,CR 不能增加顺铂对皮下 4T1 乳房的活性肿瘤 51. 在同一项研究中,禁食在增加阿霉素的耐受性方面也被证明比 CR 和 KD 更有效。 尽管禁食或 FMD,但 CR 和 KD 可能作用于并调节重叠
再喂食阶段可以
癌症预防中的禁食和口蹄疫
流行病学研究和对动物(包括猴子)108,109,144 和人类的研究支持了慢性 CR 和定期禁食和/或 FMD 可能对人类产生癌症预防作用的观点。 然而,由于依从性问题和可能的副作用 115,CR 很难在普通人群中实施。 因此,虽然基于证据的推荐(或避免)的食物以及降低癌症风险的生活方式建议正在逐渐确立 6,8,9,15、XNUMX、XNUMX、XNUMX,但现在的目标是确定并可能标准化耐受性良好的周期性具有低副作用或无副作用的饮食方案,并在临床研究中评估其预防癌症的功效。
如前所述,FMD 循环导致 IGF1 和葡萄糖的下调以及 IGFBP1 和酮体的上调,这些变化与禁食本身引起的变化相似,并且是禁食反应的生物标志物。 当 C22Bl/57 小鼠(自发发育
之前在中年小鼠中进行的为期 4 个月的隔日禁食研究也发现,禁食可降低淋巴瘤的发病率,使其从 33%(对照小鼠)降至 0%(禁食动物)145,尽管由于研究持续时间短,尚不清楚这种禁食方案是否预防或只是延迟了
因此,临床前研究的有希望的结果与关于口蹄疫对危险因素影响的临床数据相结合。
肿瘤学的临床适用性
截至今天,已发表了四项关于接受化疗的患者禁食和 FMD 的可行性研究 52,53,58,61、10、140、56。 在一个包含 58 名被诊断患有各种类型癌症(包括乳腺癌、前列腺癌、卵巢癌、子宫癌、肺癌和食道癌)的患者的病例系列中,他们在化疗前和/或化疗后 13 小时内自愿禁食长达 2 小时,没有引起重大副作用据报道,除了饥饿和头晕外,还禁食 2。 那些在禁食和不禁食的情况下接受化疗的患者(24 名)报告说,禁食期间疲劳、虚弱和胃肠道不良事件显着减少。 此外,在那些可以评估癌症进展的患者中,禁食并不能阻止化疗引起的肿瘤体积或肿瘤标志物的减少。 在另一项研究中,52 名接受泰索帝、阿霉素和环磷酰胺 (TAC) 新辅助化疗的 HERXNUMX(也称为 ERBBXNUMX)阴性、II/III 期乳腺癌的女性随机分为在开始化疗前后 XNUMX 小时禁食(仅喝水)或根据标准指南进行营养 XNUMX。
短期禁食耐受性良好,减少了化疗后 7 天平均红细胞和血小板计数的下降。 有趣的是,在这项研究中,化疗后 2 分钟,非禁食患者的白细胞中 α-H30AX(DNA 损伤的标志物)水平升高,而禁食患者的白细胞水平则没有升高。 在接受铂类化疗的患者的禁食剂量递增中,20 名患者(主要接受尿路上皮癌、卵巢癌或乳腺癌治疗)随机分为 24、48 或 72 小时禁食(分为化疗前 48 小时和化疗后 24 小时) )53. 满足可行性标准(定义为每个队列中六名受试者中的三名或更多人在禁食期间每天消耗200kcal,而没有过度毒性)。 空腹相关毒性
最近,进行了一项随机交叉临床试验,评估了口蹄疫对总共 34 名乳腺癌或卵巢癌患者的生活质量和化疗副作用的影响 61。 FMD 包括
诊所的挑战
在肿瘤学中对周期性禁食或 FMD 的研究并非没有顾虑,特别是与这种饮食方案可能导致营养不良、肌肉减少症、
结论
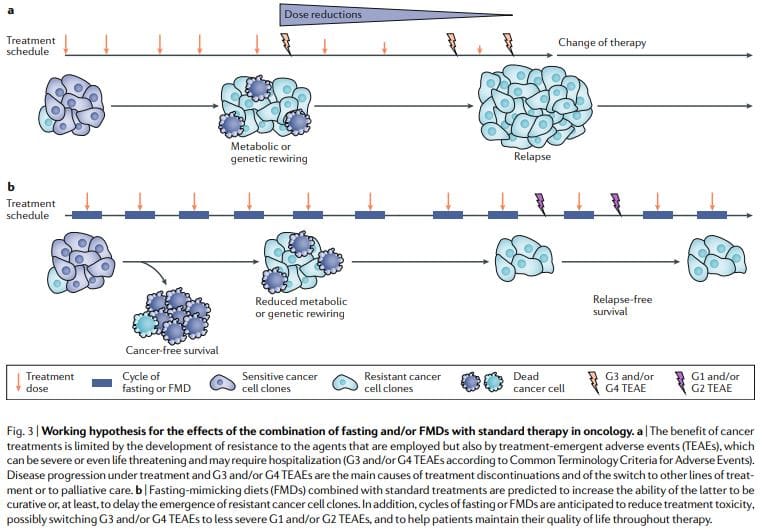
定期禁食或口蹄疫在小鼠癌症模型中始终显示出强大的抗癌作用,包括增强放化疗和 TKI 以及触发抗癌免疫的能力。 FMD 周期比慢性饮食方案更可行,因为它们允许患者在 FMD 期间定期进食,在周期之间保持正常饮食,并且不会导致严重的体重减轻以及可能对免疫和内分泌系统产生不利影响。 值得注意的是,作为独立疗法,定期禁食或 FMD 周期可能对已建立的肿瘤表现出有限的疗效。 事实上,在小鼠中,禁食或口蹄疫对许多癌症的进展的影响与化疗类似,但单独而言,它们很少与可导致无癌生存的抗癌药物联合获得的效果相媲美 11,59。 因此,我们建议,正如小鼠模型所建议的那样,定期 FMD 周期与标准治疗相结合,具有促进患者无癌生存的最大潜力 11,59(图 3)。
由于以下几个原因,这种组合可能特别有效:首先,癌症药物和其他疗法可能是有效的,但一部分患者没有反应,因为癌细胞采用了导致存活的替代代谢策略。 由于葡萄糖、某些氨基酸、激素和生长因子以及其他导致细胞死亡的未知途径的缺陷或变化,这些替代代谢模式在禁食或 FMD 条件下更难以维持。 其次,禁食或口蹄疫可以防止或减少阻力的获得。 第三,禁食或口蹄疫可以保护正常细胞和器官免受各种癌症药物引起的副作用。 基于可行性、安全性和有效性的临床前和临床证据(在减少 IGF1、内脏脂肪
此外,必须在了解作用机制的情况下应用 FMD,因为它们的效力
正在进行的癌症患者口蹄疫临床研究 63,65-68 将提供更可靠的答案,即周期性口蹄疫与常规抗癌药物联合使用是否有助于提高后者的耐受性和活性。 重要的是要考虑到口蹄疫不能有效减少所有患者癌症治疗的副作用,它们也不能提高所有疗法的疗效,但它们具有很大的潜力,至少在一部分甚至可能对于大部分患者和药物。 体弱或营养不良的患者或有营养不良风险的患者不应参加空腹或口蹄疫的临床研究,并且应在整个临床试验期间仔细监测患者的营养状况和厌食情况。
参考文献:
本文中关于“禁食与癌症:分子机制与临床应用” 无意取代与合格的医疗保健专业人员或执业医师的一对一关系,也不是医疗建议。我们鼓励您根据您的研究以及与合格的医疗保健专业人员的合作关系做出医疗保健决策。
我们的信息范围 仅限于脊椎按摩疗法、肌肉骨骼、物理药物、健康、病因 内脏障碍 在临床表现、相关的躯体内脏反射临床动力学、半脱位复合体、敏感的健康问题和/或功能医学文章、主题和讨论中。
我们提供并呈现 临床合作 与来自不同学科的专家。 每位专家均受其专业执业范围和许可管辖范围的约束。 我们使用功能性健康和保健方案来治疗和支持肌肉骨骼系统损伤或疾病的护理。
我们的视频、帖子、主题、主题和见解涵盖与我们的临床实践范围相关并直接或间接支持我们的临床事务、问题和主题。*
我们的办公室已合理尝试提供支持性引文,并已确定支持我们帖子的相关研究或研究。 我们应要求向监管委员会和公众提供支持研究的副本。
我们了解我们承保的事项需要额外解释它如何有助于特定护理计划或治疗方案; 因此,要进一步讨论上述主题,请随时询问 亚历克斯·希门尼斯博士,哥伦比亚特区, 或与我们联系 915-850-0900.
我们在这里为您和您的家人提供帮助。
祝福
Alex Jimenez博士 直流电 麻省理工学院, 注册护士*, 科技委, 国际气候变化联合会*, 国际金融中心*, ATN*
电子邮件: Coach@elpasofunctionalmedicine.com
获得脊椎按摩疗法医生 (DC) 执照 德州 & 新墨西哥*
德克萨斯州特区许可证# TX5807,新墨西哥州 DC 许可证# NM-DC2182
获得注册护士 (RN*) 执照 in 佛罗里达
佛罗里达州执照 注册护士执照 # RN9617241 (控制编号 3558029)
紧凑状态: 多州许可证: 授权执业于 40个州*
Alex Jimenez 博士 DC、MSACP、RN* CIFM*、IFMCP*、ATN*、CCST
我的数字名片