氧化应激
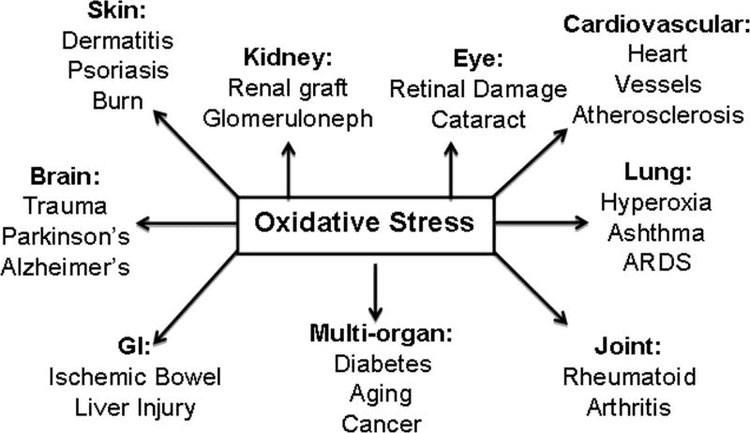
背部诊所氧化应激脊椎按摩疗法和功能医学团队。 氧化应激被定义为活性氧(自由基)的产生和抗氧化防御之间的平衡紊乱。 换句话说,它是自由基的产生与身体通过抗氧化剂中和来抵消或解毒有害影响的能力之间的不平衡。 氧化应激导致身体出现许多病理生理状况。 这些包括神经退行性疾病,即帕金森病、阿尔茨海默病、基因突变、癌症、慢性疲劳综合征、脆性X综合征、心脏和血管疾病、动脉粥样硬化、心力衰竭、心脏病发作和炎症性疾病。 氧化发生在多种情况下:
细胞利用葡萄糖制造能量
免疫系统正在抵抗细菌并产生炎症
身体排毒污染物,农药和香烟烟雾
在任何给定时间,人体中都会发生数百万个可能导致氧化的过程。 以下是一些症状:
疲劳
记忆力减退和/或脑雾
肌肉和/或关节痛
满头白发的皱纹
视力下降
头痛和对噪音的敏感性
易感染
选择有机食品并避免环境中的毒素会产生很大的不同。 这与减少压力一起,有助于减少氧化。

by 亚历克斯·希门尼斯博士 | 功能医学, 健康管理, 心理健康, 氧化应激, 健康
你感觉:
- 晚上睡不着?
- 你早上开始很慢?
- 午后疲倦?
- 即使在睡了六个或更多小时后醒来还是很累?
- 在很大的压力下?
如果您遇到任何这些情况,则可能是由于您的褪黑激素和皮质醇水平影响了您的身体和昼夜节律。
在世界各地,数百万人难以入睡。 在美国,大约有 50-70百万人 睡眠质量差的人。 当一个人睡不到八小时时,他们会感到疲倦,并且会遇到很多问题,尤其是当他们的生活忙碌时。 忙碌的生活方式和糟糕的睡眠会导致身体无法完成任何任务,皮质醇压力荷尔蒙会升高,高血压和糖尿病等疾病可能会导致慢性问题治疗。

在功能内分泌学中,褪黑激素和皮质醇是人体自然产生的激素。 皮质醇激素或压力激素帮助身体处于“战斗或逃跑”模式,这对任何正在做项目或参加工作面试的人来说都是一件好事。 虽然当皮质醇激素水平高时,它会导致身体出现炎症、慢性氧化应激和高血压等并发症。
褪黑激素昼夜节律
使用褪黑激素,这种激素会告诉身体什么时候该睡觉。 但有时,人们确实很难入睡,服用褪黑激素补充剂实际上可以放松身体,从而使人入睡。 由于松果体从大脑中产生褪黑激素,它也可以在眼睛、骨髓和肠道中找到,以放松身体,使人自然入睡。 一些 研究表明, 产生褪黑激素的松果体的昼夜节律。 通过这样做,研究表明褪黑激素的给药可以:
- 一个: 让难以入睡的人入睡。
- 二:抑制身体从昼夜节律起搏器中自然醒来。
- 三种:当一个人试图早睡以获得完整的八小时睡眠益处时,改变生物钟以增加睡眠摄入量。
当一个人在朝九晚五的工作中工作时,他们会在一天的辛苦工作后随着自己的身体站起来放松身体。 研究发现 褪黑激素和皮质醇激素极大地帮助调节身体功能和反应的 24 小时模式。 随着身体的激素产生周期,如果一个人在深夜保持清醒或白天睡觉,它可能会受到干扰。 发生这种情况时,该人可能会出现破坏性障碍,例如情绪波动、头晕、易怒和抑郁,以及代谢紊乱。 不仅如此,身体的免疫系统及其内分泌系统也可能受到损害,导致身体成为感染和疾病的宿主。
已经有更多关于身体昼夜节律的研究,如 研究表明 夜班工作的人如何与大量不利的健康问题相关联,这些问题会攻击心血管和胃肠系统以及扰乱新陈代谢系统。 任何上夜班的人都必须改变他们的睡眠时间表,并适应他们睡眠/醒来时间表中的快速重新定位,才能上班和完成工作。 由于每个人都在轮班工作,因此压力很大,会影响工人的身体表现,也会影响褪黑激素和皮质醇的分泌。
支持皮质醇和褪黑激素的方法
但令人惊讶的是,有一些方法可以降低皮质醇水平,并确保褪黑激素水平正常工作以使身体正常运作。 为了降低皮质醇水平,一个人应该进行冥想练习,找到一个愉快的爱好,最重要的是,尝试深呼吸练习以放松身体免受不必要的压力。 通过深呼吸练习,它可以帮助身体释放一个人所持有的任何紧张感,身体的肌肉开始放松,血液开始流动。 随着褪黑激素的水平,它们与身体的昼夜节律一起工作,确保身体知道什么时候该起床、睡觉和吃饭。 褪黑激素还可以帮助调节体温, 胃和食管静脉血压增高和激素水平,以确保其正常运行。 当这些系统的水平很高时,它会导致身体发展为慢性疾病并在此过程中伤害身体。
研究显示 褪黑激素可以与体内的神经受体结合,从而促进放松。 由于褪黑激素与神经受体结合,它还可以降低神经活动和多巴胺水平,使眼睛变得沉重,从而使人入睡。
结论
身体能够自然地产生褪黑激素和皮质醇水平,以确保身体在一整天内不会受到过度压力。 由于褪黑激素与身体的昼夜节律有关,因此身体知道何时起床和入睡。 由于每个人都有一个忙碌的日程安排,因此必须花时间放松并保持健康的睡眠时间表,这样身体才能健康并发挥作用。 一些 产品及技术 在这里确保内分泌系统正常运作并支持肾上腺和糖代谢。
我们的信息范围仅限于脊椎治疗,肌肉骨骼和神经健康问题或功能性医学文章,主题和讨论。 我们使用功能性健康协议来治疗肌肉骨骼系统的损伤或失调。 我们的办公室已做出合理的尝试以提供支持性引用,并确定了相关研究或支持我们职位的研究。 我们还应要求向董事会和/或公众提供支持研究的副本。 要进一步讨论上述主题,请随时询问Alex Jimenez博士或通过以下方式与我们联系 915-850-0900.
参考文献:
Cajochen,C,等人。 “褪黑激素在调节人类昼夜节律和睡眠中的作用。” 神经内分泌学杂志,美国国家医学图书馆,2003 年 12622846 月,www.ncbi.nlm.nih.gov/pubmed/XNUMX。
詹姆斯,弗朗辛 O 等人。 “模拟夜班工作期间褪黑激素、皮质醇和时钟基因表达的昼夜节律。” 睡觉, Associated Professional Sleep Societies, LLC,2007 年 2082093 月,www.ncbi.nlm.nih.gov/pmc/articles/PMCXNUMX/。
Monteleone,P,等人。 “褪黑激素和皮质醇对人类夜间身体压力的反应之间的时间关系。” 心理神经,美国国家医学图书馆,1992年,www.ncbi.nlm.nih.gov / pubmed / 1609019。
拉曼,瑞恩。 “褪黑激素如何帮助您睡眠和感觉更好。” 健康热线,健康热线媒体,3 年 2017 月 XNUMX 日,www.healthline.com/nutrition/melatonin-and-sleep。
扎马尼安、扎赫拉等人。 “设拉子医科大学保安人员皮质醇和褪黑激素昼夜节律变化概述。” 国际预防医学杂志, Medknow Publications & Media Pvt Ltd,2013 年 3775223 月,www.ncbi.nlm.nih.gov/pmc/articles/PMCXNUMX/。
通过向个人介绍国立卫生科学大学如何为想要改变世界的后代提供知识。 该大学为功能医学和综合医学提供广泛的医学专业。

by 亚历克斯·希门尼斯博士 | 肠道和肠道健康, 氧化应激
有没有想过为什么你会因为漫长的一天而感到迟钝? 或者当你吃了不好的东西或过度沉迷于你最喜欢的食物时会感到胃不舒服? 会不会是由于您可能遇到但甚至不知道的某些习惯而导致您的肠道出现压力和不适的迹象?
在我们之前的文章中,我们谈到了 六种食物 我们的肠道需要健康。 由于我们的直觉 包含 数以万亿计的微生物组,无论好坏,这些微生物组在我们的整体健康中发挥着重要作用。 健康的微生物组可以改善我们的 肠道健康, 心脏健康, 大脑健康, 控制我们的体重 和 调节我们的血糖. 有了我们肠道中的好细菌,这些细菌就会通过良好的消化系统使我们受益,并破坏有害细菌。 但某些生活方式和饮食选择实际上会增加有害细菌,降低有益细菌和整体健康。
以下是五种令人惊讶的生活方式选择,它们正在伤害您的肠道:
不吃各种各样的食物
我们的肠道在我们的整体健康中起着重要作用。 当我们吃到优质的天然食物时,我们的肠道会更快乐; 我们有更多的精力来完成任何交给我们的任务,我们正在 我们肠道菌群的营养物质. 然而,在过去的几十年里,由于食品产量增加带来的经济压力,我们更倾向于加工食品。 福阿 声明“世界上 75% 的食物仅来自 12 种植物和 XNUMX 种动物”,这对我们的肠道菌群非常不利。
在 Injury Medical & Chiropractic Clinic,我们告知我们的患者食用营养丰富的全食物的重要性,这不仅可以促进肠道健康,还可以促进健康的头脑。 当身体被引入 各种各样的全食物 (具有高纤维含量),我们的肠道开始修复我们可能在内部消耗的加工食品的损害。
益生元摄入不足
益生元 是不需要消化的纤维,可以通过我们的肠道。 然而,这似乎是一种浪费,益生元 鼓励友好的细菌在我们的肠道中生长。 任何像苹果这样的高纤维水果实际上都有助于成长 双歧杆菌等微生物.
然而,当你在饮食中忽视益生元时,你 损害您的消化系统健康. 如果没有益生元,我们的消化系统会减慢肠道菌群的发育和多样性。 所以为了拥有一个 健康的微生物组 发展,你需要在你的饮食中加入富含可消化和难消化纤维的食物。 此类别中包括的一些食物是燕麦、坚果、洋葱、大蒜、韭菜、芦笋、香蕉、梨、鹰嘴豆和豆类。
坚持高纤维饮食可能具有挑战性,但是可以选择服用益生元补充剂。 如果您对任何高浓缩纤维食物有食物过敏原或食物敏感,请服用 益生元补充剂 实际上可以帮助双歧杆菌和粪杆菌在您的肠道中生长,并且对您的健康有益而不会感到不适。
过量饮酒
每个成年人都会偶尔喝点酒。 是的,它是一种可以帮助您在漫长的一天后放松一下的饮料,但是,过多会导致酗酒和成瘾。 所以,你知道喝那么多酒对身体有害吗? 你的心脏、肝脏和大脑; 从而损害您的肠道健康并导致您的生态失调?
一项研究 指出,患有生态失调的酗酒者的拟杆菌属丰度中值较低,而变形菌属的丰度较高。 那些不是酗酒者不受这项研究的影响。
然而; 有一些关于限制自己酗酒的好消息,它可能对你的肠道细菌有益。 如果你适度负责任地饮用红酒, 茶多酚 在葡萄酒中可以帮助有益于您的肠道菌群。 所以,偶尔享用一杯葡萄酒,作为一种不应该被视为理所当然的小享受。
睡眠不足
在之前的一篇文章中,我们谈到了如何实现 睡个好觉 通过草药。 当我们在忙碌的生活中几乎没有睡眠时,它会通过各种健康问题影响我们,包括 心脏疾病 和 肥胖。 在 2016研究,研究人员在两天后发现了短期睡眠剥夺对肠道微生物群的影响。
当我们的身体没有得到建议的 8 小时睡眠时,我们的肠道会因为我们感到迟钝和疲惫而遭受巨大的损失。 所以,为了确保我们的 肠道微生物群 将得到照顾,我们建议您在准备安顿下来过夜之前至少 30 分钟关闭您的电子设备。 关掉所有的灯,睡前至少两个小时不要喝任何液体,闭上眼睛,在冥想状态下深呼吸,然后在你飘入沉睡的小镇时放松一下。
运动不足
通过我们快节奏的生活方式和压力大的工作,我们很难抽出时间锻炼。 但是,当我们真的抽出时间锻炼身体时,不仅我们的大脑感觉良好; 但我们的身体和肠道也感觉良好。 然而,当我们进行日常锻炼时,总会出现问题,我们不得不完全跳过锻炼。 它发生在我们所有人身上,当我们尝试锻炼时,很难从中断的地方继续。
当我们每周至少有几次不锻炼时,我们的身体会因为体重增加而对我们造成巨大的影响,我们的 压力太大了,我们有一个 更高的机会 患上慢性病。 当这种情况发生时,我们的肠道菌群是一个巨大的劣势。 在诊所,我们努力让我们的患者了解锻炼的重要性,锻炼不仅改变了他们的生活,还彻底改变了他们的情绪。
但是,不要只是进行艰苦的锻炼,否则会伤到自己。 从低强度的锻炼开始,然后在你进行的过程中进行锻炼,因为你的肠道菌群会为此感谢你。
最后,我们 Injury Medical 希望通过这 5 个惊喜让您了解营养和帮助您改善疾病的方法。 但也要教育你什么可能会伤害你的肠道。 有了这些惊喜和日常生活的微小变化,你的直觉会感谢你长久以来的付出。
NCBI资源
根据 2016 年研究的证据, 肠道免疫系统是预防多种疾病的基础,它可能经常导致代谢紊乱。 然而,在观察胰岛素抵抗的全身炎症时,它也可能有助于提供治疗目标。 此外,改良的肠道免疫与肠道微生物群、肠道屏障功能、肠道内免疫细胞的变化以及对进入胃肠道或胃肠道系统的抗原的抵抗力有关。 尽管以前认为这会增加食道疾病的危险,包括致病性感染和慢性炎症,这可能最终导致慢性健康问题。
by 亚历克斯·希门尼斯博士 | 抗衰老, 排毒, 饮食, 功能医学, 健康管理, 健康新闻埃尔帕索, 整体医学, 生酮饮食的解释, 自然健康, 营养学, 氧化应激, 补救措施, 研究研究, 补充品, 疗程, 健康
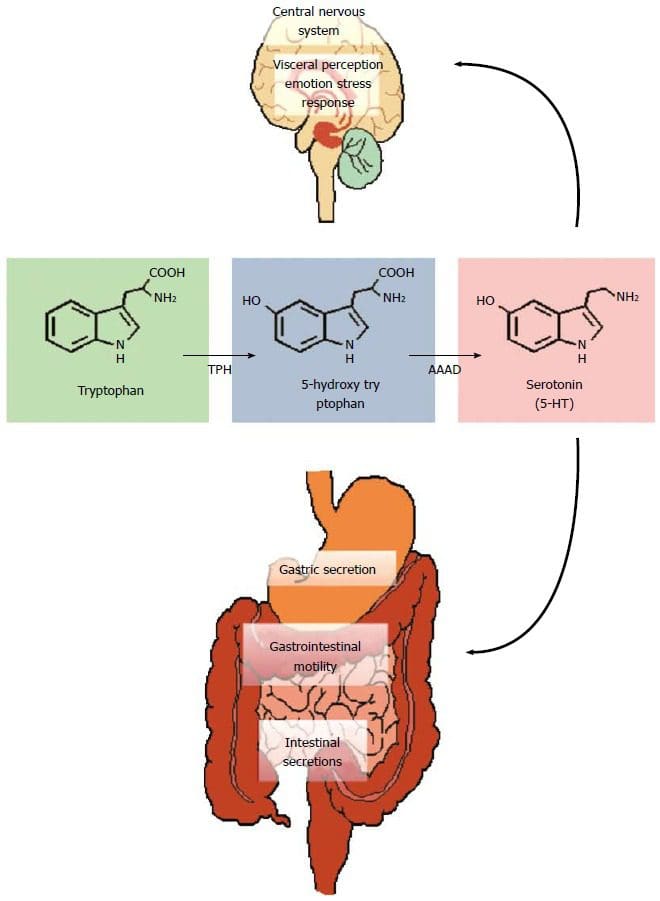
酮体由肝脏产生,当葡萄糖在人体中不易获得时用作能量来源。 两种主要的酮体是乙酰乙酸酯 (AcAc) 和 3-β-羟基丁酸酯 (3HB),而丙酮是第三种也是最不丰富的酮体。 酮体始终存在于血液中,并且在禁食和长时间运动期间它们的水平会增加。生酮作用 是生物体通过分解脂肪酸和生酮氨基酸产生酮体的生化过程。
酮体主要产生于 肝细胞线粒体. 当血液中的葡萄糖水平低时,尤其是在其他细胞碳水化合物储存(如糖原)耗尽后,就会发生生酮作用。 当胰岛素量不足时,也会发生这种机制。 酮体的产生最终被启动以提供可用的能量,这些能量以脂肪酸的形式储存在人体内。 生酮发生在线粒体中,在那里它被独立调节。
抽象
酮体代谢是生理稳态的中心节点。 在这篇综述中,我们讨论了酮如何发挥离散的微调代谢作用,优化器官和生物体在不同营养残留物中的表现,并保护多个器官系统免受炎症和损伤。 传统上被视为仅在碳水化合物限制中加入的代谢底物,最近的观察强调了当碳水化合物丰富时酮体作为重要的代谢和信号传导介质的重要性。 作为对神经系统疾病已知治疗方案的补充,酮体在癌症中的预期作用已经出现,在心脏和肝脏中也具有有趣的保护作用,为肥胖相关疾病和心血管疾病开辟了治疗选择。 讨论了酮代谢和信号传导方面的争议,以调和经典教条与当代观察。
介绍
酮体是所有生命领域、真核生物、细菌和古细菌的重要替代代谢燃料来源(Aneja 等人,2002;Cahill GF Jr,2006;Krishnakumar 等人,2008)。 人类的酮体代谢已被用来在营养缺乏的偶发时期为大脑提供燃料。 酮体与关键的哺乳动物代谢途径交织在一起,例如 α-氧化 (FAO)、三羧酸循环 (TCA)、糖异生、从头脂肪生成 (DNL) 和甾醇的生物合成。 在哺乳动物中,酮体主要在肝脏中由FAO衍生的乙酰辅酶A产生,它们被运输到肝外组织进行终末氧化。 这种生理学提供了一种替代燃料,通过相对较短的禁食时间来增强,这增加了脂肪酸的利用率并减少了碳水化合物的利用率(Cahill GF Jr,2006;McGarry 和 Foster,1980;Robinson 和 Williamson,1980)。 在多种生理状态下,酮体氧化成为哺乳动物肝外组织内整体能量代谢的重要贡献者,包括禁食、饥饿、新生儿期、运动后、怀孕和坚持低碳水化合物饮食。 健康成年人的循环总酮体浓度通常表现出约 100-250 μM 之间的昼夜节律波动,在长时间运动或禁食 1 小时后升高至约 24 mM,并且在糖尿病酮症酸中毒等病理状态下可累积高达 20 mM。 Cahill GF Jr,2006;Johnson 等人,1969b;Koeslag 等人,1980;Robinson 和 Williamson,1980;Wildenhoff 等人,1974)。 人体肝脏每天可产生高达 300 克的酮体(Balasse 和 Fery,1989 年),占进食、禁食和饥饿状态下总能量消耗的 5-20%(Balasse 等人,1978 年;Cox 等人)等人,2016)。
最近的研究现在强调了酮体在哺乳动物细胞代谢、体内平衡和各种生理和病理状态下的信号传导中的重要作用。 除了作为脑、心脏或骨骼肌等肝外组织的能量燃料外,酮体还作为信号传导介质、蛋白质翻译后修饰 (PTM) 的驱动因素以及炎症和氧化应激的调节剂发挥着关键作用。 在这篇综述中,我们提供了关于酮体的多效作用及其代谢的经典和现代观点。
酮体代谢概述
肝脏生酮的速率受一系列精心安排的脂肪生理和生化转化的控制。 主要调节剂包括脂肪酸从三酰基甘油脂解、转运至肝细胞质膜并穿过肝细胞质膜、通过肉碱棕榈酰转移酶 1 (CPT1) 转运至线粒体、α-氧化螺旋、TCA 循环活性和中间浓度、氧化还原电位和激素调节剂在这些过程中,主要是胰高血糖素和胰岛素 [综述于 (Arias et al., 1995; Ayte et al., 1993; Ehara et al., 2015; Ferre et al., 1983; Kahn et al., 2005; McGarry and Foster ,1980 年;威廉姆森等人,1969 年)]。 经典的生酮被视为溢出途径,其中 α-氧化衍生的乙酰辅酶 A 超过柠檬酸合酶活性和/或草酰乙酸可用于缩合以形成柠檬酸。 三碳中间体表现出抗生酮活性,可能是由于它们能够扩大草酰乙酸池以消耗乙酰辅酶A,但仅肝脏乙酰辅酶A浓度并不能决定生酮率(Foster,1967;Rawat 和 Menahan,1975;Williamson等人,1969)。 激素、转录和翻译后事件对生酮的调节共同支持了微调生酮率的分子机制仍未完全了解的观点(参见 HMGCS2 和 SCOT/OXCT1 的调节)。
生酮主要以与总脂肪氧化成比例的速率发生在肝线粒体基质中。 在酰基链跨线粒体膜转运和 α-氧化后,3-羟甲基戊二酰辅酶 A 合酶 (HMGCS2) 的线粒体异构体催化乙酰乙酰辅酶 A (AcAc-CoA) 和乙酰辅酶 A 缩合生成 HMG-CoA (图 1A)。 HMG-CoA 裂解酶 (HMGCL) 裂解 HMG-CoA 以释放乙酰辅酶 A 和乙酰乙酸 (AcAc),后者被磷脂酰胆碱依赖性线粒体 d-αOHB 脱氢酶还原为 d-α-羟基丁酸 (d-αOHB)。 BDH1)在 NAD+/NADH 耦合的近平衡反应中(Bock 和 Fleischer,1975;LEHNINGER 等人,1960)。 BDH1 平衡常数有利于 d-?OHB 的产生,但 AcAc/d-?OHB 酮体的比率与线粒体 NAD+/NADH 比率成正比,因此 BDH1 氧化还原酶活性调节线粒体氧化还原电位(Krebs 等,1969;威廉姆森等人,1967)。 AcAc 也可以自发脱羧生成丙酮(Pedersen,1929),这是人类酮症酸中毒的甜味来源(即,总血清酮体 > ~7 mM;AcAc pKa 3.6,?OHB pKa 4.7)。 酮体通过线粒体内膜转运的机制尚不清楚,但 AcAc/d-αOHB 通过单羧酸转运蛋白(在哺乳动物中,MCT 1 和 2,也称为溶质载体 16A 家族成员 1 和7) 并在循环中运输到肝外组织进行终末氧化 (Cotter et al., 2011; Halestrap and Wilson, 2012; Halestrap, 2012; Hugo et al., 2012)。 循环酮体的浓度高于肝外组织中的浓度(Harrison 和 Long,1940),表明酮体沿浓度梯度向下输送。 MCT1 的功能丧失突变与酮症酸中毒的自发发作有关,表明在酮体输入中起关键作用。
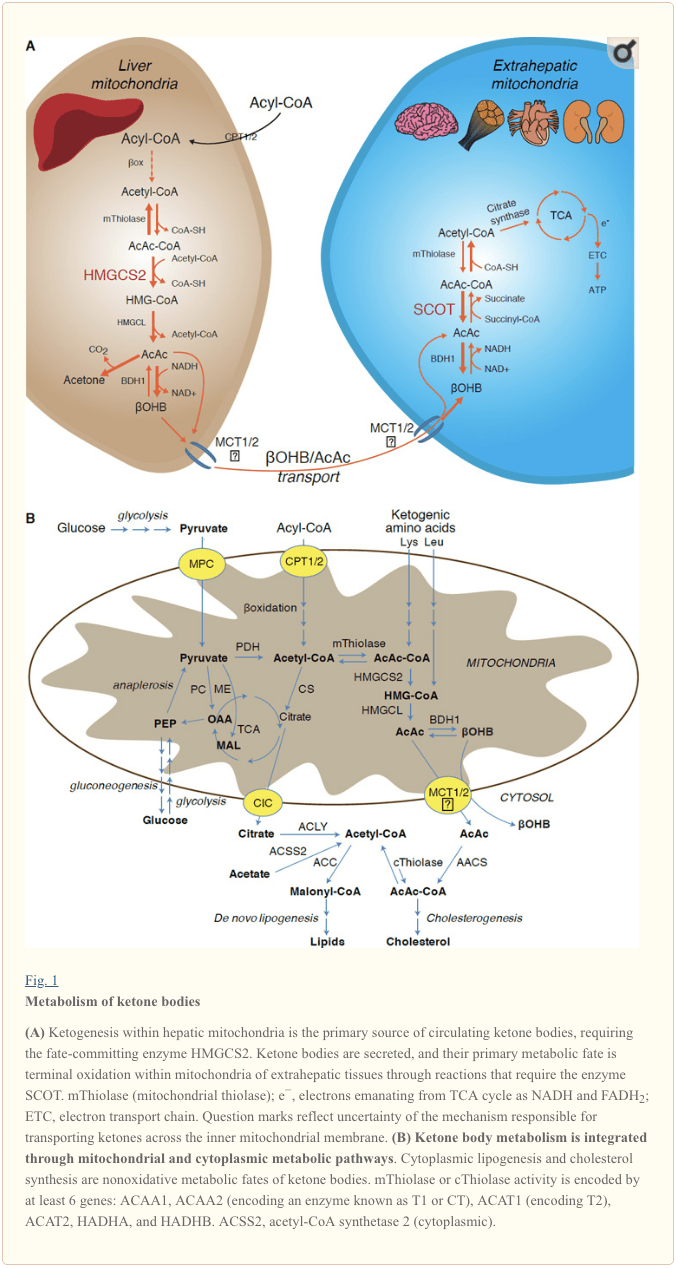
� 除了可能将酮体转化为非氧化命运(见酮体的非氧化代谢命运)外,肝细胞缺乏代谢它们产生的酮体的能力。 由肝脏从头合成的酮体(i)在肝外组织的线粒体中分解代谢为乙酰辅酶A,乙酰辅酶A可用于TCA循环进行终末氧化(图1A),(ii)转向脂肪生成或甾醇合成途径(图 1B),或 (iii) 从尿中排出。 作为一种替代的高能燃料,酮体在心脏、骨骼肌和大脑中被强烈氧化(Balasse 和 Fery,1989;Bentourkia 等,2009;Owen 等,1967;Reichard 等,1974;Sultan,1988 )。 肝外线粒体 BDH1 催化 ?OHB 氧化的第一个反应,将其转化为 AcAc(LEHNINGER 等人,1960;Sandermann 等人,1986)。 与 BDH2 仅具有 20% 序列同一性的细胞质 d-?OHB-脱氢酶 (BDH1) 对酮体具有高 Km,并且还在铁稳态中发挥作用 (Davuluri et al., 2016; Guo et al., 2006) . 在肝外线粒体基质中,在由独特的哺乳动物 CoA 转移酶琥珀酰-CoA:3-氧代酸-CoA 转移酶(SCOT,CoA 转移酶;由 OXCT1 编码),通过近平衡反应。 AcAc-CoA 水解释放的自由能大于琥珀酰-CoA,有利于 AcAc 的形成。 因此,酮体氧化通量由于质量作用而发生:丰富的 AcAc 供应和通过柠檬酸合酶快速消耗的乙酰辅酶 A 有利于 SCOT 形成 AcAc-CoA(+ 琥珀酸)。 值得注意的是,与葡萄糖(己糖激酶)和脂肪酸(酰基辅酶 A 合成酶)相比,将酮体 (SCOT) 激活为可氧化形式不需要 ATP 的投入。 可逆的 AcAc-CoA 硫解酶反应 [由 ACAA2(编码称为 T1 或 CT 的酶)、ACAT1(编码 T2)、HADHA 或 HADHB 编码的四种线粒体硫解酶中的任何一种催化] 产生两个乙酰辅酶 A 分子,进入 TCA 循环(Hersh 和 Jencks,1967;Stern 等人,1956;Williamson 等人,1971)。 在酮状态(即总血清酮> 500 μM)期间,酮体成为能量消耗的重要贡献者,并在组织中迅速利用,直到发生吸收或氧化饱和(Balasse 等,1978;Balasse 和 Fery,1989 ;埃德蒙等人,1987 年)。 一小部分来源于肝脏的酮体可以很容易地在尿液中测量,肾脏的利用和重吸收率与循环浓度成正比(Goldstein,1987;Robinson 和 Williamson,1980)。 在高度酮症状态(血浆中 > 1 mM)期间,酮尿可作为酮症的半定量报告,尽管大多数尿酮体临床试验检测到 AcAc 而不是 ?OHB(Klocker 等,2013)。
生酮底物及其对肝细胞代谢的影响
生酮底物包括脂肪酸和氨基酸(图 1B)。 氨基酸的分解代谢,尤其是亮氨酸,在吸收后产生约 4% 的酮体(Thomas 等,1982)。 因此,产生酮体的乙酰辅酶A底物库主要来自脂肪酸,因为在碳水化合物供应减少的状态下,丙酮酸主要通过回补作用进入肝脏 TCA 循环,即 ATP 依赖性羧化为草酰乙酸 (OAA) 或苹果酸(MAL),而不是氧化脱羧成乙酰辅酶A(Jeoung 等人,2012;Magnusson 等人,1991;Merritt 等人,2011)。 在肝脏中,葡萄糖和丙酮酸对生酮的贡献可以忽略不计,即使丙酮酸脱羧为乙酰辅酶 A 的作用最大(Jeoung 等,2012)。
乙酰辅酶 A 在通过末端氧化产生 ATP 之外,还包含肝脏中间代谢不可或缺的几个角色(另见酮体代谢、翻译后修饰和细胞生理学的整合)。 乙酰辅酶 A 变构激活 (i) 丙酮酸羧化酶 (PC),从而激活代谢控制机制,增强代谢物回补进入 TCA 循环(Owen 等人,2002;Scruton 和 Utter,1967)和(ii)丙酮酸脱氢酶激酶,它磷酸化并抑制丙酮酸脱氢酶 (PDH) (Cooper et al., 1975),从而进一步增强丙酮酸通过回补作用流入 TCA 循环。 此外,细胞质乙酰辅酶A(其池通过将线粒体乙酰辅酶A转化为可转运代谢物的机制增加)抑制脂肪酸氧化:乙酰辅酶A羧化酶(ACC)催化乙酰辅酶A转化为丙二酰辅酶A,即脂肪生成底物和线粒体 CPT1 的变构抑制剂 [综述于 (Kahn et al., 2005; McGarry and Foster, 1980)]。 因此,线粒体乙酰辅酶A池既调节又受生酮溢出途径的调节,该途径协调肝脏中间代谢的关键方面。
酮体的非氧化代谢命运
肝源性酮的主要命运是 SCOT 依赖性肝外氧化。 然而,AcAc 可以从线粒体输出并通过由细胞质乙酰乙酰辅酶 A 合成酶催化的 ATP 依赖性反应转化为 AcAc-CoA 用于合成代谢途径(AACS,图 1B)。 该通路在大脑发育和哺乳期乳腺中是活跃的(Morris,2005;Robinson 和 Williamson,1978;Ohgami 等,2003)。 AACS 在脂肪组织和活化的破骨细胞中也高度表达(Aguilo 等人,2010;Yamasaki 等人,2016)。 细胞质 AcAc-CoA 可以被细胞质 HMGCS1 引导至甾醇生物合成,或被两种细胞质硫解酶中的任何一种裂解为乙酰辅酶 A(ACAA1 和 ACAT2),羧化为丙二酰辅酶 A,并有助于脂肪酸的合成(Bergstrom 等人)。 al., 1984; Edmond, 1974; Endemann et al., 1982; Geelen et al., 1983; Webber and Edmond, 1977)。
虽然生理意义尚未确定,但酮甚至可以在肝脏中作为合成代谢底物。 在人工实验环境中,AcAc 可贡献多达一半的新合成脂质和高达 75% 的新合成胆固醇(Endemann 等人,1982;Geelen 等人,1983;Freed 等人,1988)。 由于 AcAc 来源于不完全的肝脏脂肪氧化,因此 AcAc 在体内促进脂肪生成的能力意味着肝脏无效循环,其中脂肪衍生的酮可用于脂质生产,这一概念的生理意义需要实验验证,但可以服务适应或适应不良的角色(Solinas et al., 2015)。 AcAc 热衷于提供胆固醇生成,即使在进食状态下,AACS Km-AcAc (~50 µM) 也有利于 AcAc 活化(Bergstrom 等人,1984 年)。 细胞质酮代谢的动态作用已在原代小鼠胚胎神经元和 3T3-L1 衍生的脂肪细胞中提出,因为 AACS 敲低损害了每种细胞类型的分化(Hasegawa 等人,2012a;Hasegawa 等人,2012b)。 在体内敲除小鼠 AACS 可降低血清胆固醇(Hasegawa 等人,2012c)。 SREBP-2,胆固醇生物合成的主要转录调节因子,和过氧化物酶体增殖物激活受体 (PPAR)-? 是 AACS 转录激活剂,并在神经突发育和肝脏中调节其转录(Aguilo 等人,2010;Hasegawa 等人,2012c)。 总而言之,细胞质酮体代谢可能在特定条件或疾病自然史中很重要,但不足以处理源自肝脏的酮体,因为大量高酮血症发生在通过功能突变丧失对初级氧化命运的选择性损害的情况下到 SCOT(Berry 等人,2001 年;Cotter 等人,2011 年)。
HMGCS2和SCOT/OXCT1的调节
线粒体与编码细胞溶质 HMGCS 的基因的分歧发生在脊椎动物进化的早期,因为需要支持具有较高脑体重比的物种的肝生酮作用(Boukaftane 等,1994;Cunnane 和 Crawford,2003)。 人类自然发生的功能丧失 HMGCS2 突变会导致低酮症低血糖发作(Pitt 等人,2015;Thompson 等人,1997)。 强大的 HMGCS2 表达仅限于肝细胞和结肠上皮,其表达和酶活性通过多种机制进行协调(Mascaro 等,1995;McGarry 和 Foster,1980;Robinson 和 Williamson,1980)。 虽然影响 HMGCS2 的全部生理状态需要进一步阐明,但其表达和/或活性在产后早期、衰老、糖尿病、饥饿或摄入生酮饮食期间受到调节(Balasse 和 Fery,1989;Cahill GF Jr,2006 ;Girard 等人,1992;Hegardt,1999;Satapati 等人,2012;Sengupta 等人,2010)。 在胎儿中,Hmgcs5 基因 2’ 侧翼区域的甲基化与其转录呈负相关,并且在出生后部分逆转(Arias 等人,1995;Ayte 等人,1993;Ehara 等人,2015;Ferre 等人) ., 1983)。 类似地,肝脏 Bdh1 表现出发育表达模式,从出生到断奶增加,并且也由生酮饮食以成纤维细胞生长因子 (FGF)-21 依赖性方式诱导 (Badman et al., 2007; Zhang et al., 1989 )。 哺乳动物的生酮对胰岛素和胰高血糖素高度敏感,分别受到抑制和刺激(McGarry 和 Foster,1977)。 胰岛素抑制脂肪组织的脂肪分解,从而剥夺其底物的生酮作用,而胰高血糖素通过对肝脏的直接作用增加生酮通量(Hegardt,1999)。 Hmgcs2 转录受到叉头转录因子 FOXA2 的刺激,FOXA3 通过胰岛素-磷脂酰肌醇-300-激酶/Akt 抑制,并由胰高血糖素-cAMP-p1995 信号传导诱导(Arias 等,1999;Hegardt,1990;Quant 等。 , 1993; Thumelin 等人, 2013; von Meenn 等人, 2004; Wolfrum 等人, 2003; Wolfrum 等人, XNUMX)。 帕帕? (Rodriguez et al., 1994) 连同它的靶标 FGF21 (Badman et al., 2007) 也在饥饿或生酮饮食管理期间在肝脏中诱导 Hmgcs2 转录 (Badman et al., 2007; Inagaki et al., 2007) )。 PPAR的诱导? 可能发生在从胎儿到新生儿生理学的转变之前,而 FGF21 的激活可能通过 ?OHB 介导的组蛋白去乙酰化酶 (HDAC)-3 抑制在新生儿早期受到青睐 (Rando et al., 2016)。 mTORC1(雷帕霉素复合物 1 的哺乳动物靶标)对 PPAR 的依赖性抑制? 转录活性也是 Hmgcs2 基因表达的关键调节因子 (Sengupta et al., 2010),肝脏 PER2 是一种主要的昼夜节律振荡器,间接调节 Hmgcs2 表达 (Chavan et al., 2016)。 最近的观察表明,肝外肿瘤诱导的白细胞介素 6 通过 PPAR 损害酮生成? 抑制(Flint 等人,2016 年)。
HMGCS2 酶活性通过多个 PTM 进行调节。 HMGCS2 丝氨酸磷酸化增强了其体外活性(Grimsrud 等,2012)。 HMGCS2 活性受到琥珀酰辅酶 A 和赖氨酸残基琥珀酰化的变构抑制(Arias 等人,1995;Hegardt,1999;Lowe 和 Tubbs,1985;Quant 等人,1990;Rardin 等人,2013;Reed 等人, 1975 年;图梅林等人,1993 年)。 肝线粒体中 HMGCS2、HMGCL 和 BDH1 赖氨酸残基的琥珀酰化是 NAD+ 依赖性脱酰基酶 sirtuin 5 (SIRT5) 的靶标(Rardin 等,2013)。 SIRT2 赖氨酸脱乙酰化也增强了 HMGCS3 活性,乙酰化和琥珀酰化之间的串扰可能调节 HMGCS2 活性(Rardin 等人,2013;Shimazu 等人,2013)。 尽管这些 PTMs 能够调节 HMGCS2 Km 和 Vmax,但这些 PTMs 的波动尚未被仔细绘制,也未被证实为体内生酮的机制驱动因素。
SCOT 在所有含有线粒体的哺乳动物细胞中表达,肝细胞除外。 在 SCOT-KO 小鼠中证明了 SCOT 活性和酮分解的重要性,由于出生后 48 小时内出现高酮血症性低血糖,其表现出均匀的致死率(Cotter 等,2011)。 神经元或骨骼肌细胞中 SCOT 的组织特异性损失会在饥饿期间诱导代谢异常,但不是致命的(Cotter 等人,2013b)。 在人类中,SCOT 缺乏症在生命早期出现严重的酮症酸中毒,导致嗜睡、呕吐和昏迷(Berry 等人,2001;Fukao 等人,2000;Kassovska-Bratinova 等人,1996;Niezen-Koning 等人。 , 1997 年;Saudubray 等人,1987 年;Snyderman 等人,1998 年;Tildon 和 Cornblath,1972 年)。 在细胞水平上,关于 SCOT 基因和蛋白质表达调节剂的了解相对较少。 Oxct1 mRNA 表达和 SCOT 蛋白和活性在酮症状态下降低,可能通过 PPAR 依赖机制(Fenselau 和 Wallis,1974;Fenselau 和 Wallis,1976;Grinblat 等,1986;Okuda 等,1991;Turko 等.,2001 年;Wentz 等人,2010 年)。 在糖尿病酮症酸中毒中,肝脏生酮和肝外氧化之间的不匹配因SCOT活性受损而加剧。 心肌细胞中胰岛素非依赖性葡萄糖转运蛋白 (GLUT1/SLC2A1) 的过表达也会抑制 Oxct1 基因表达并下调非酮状态下的酮末端氧化 (Yan et al., 2009)。 在肝脏中,Oxct1 mRNA 丰度受到 microRNA-122 和组蛋白甲基化 H3K27me3 的抑制,这在从胎儿到新生儿期的过渡期间很明显(Thorrez 等,2011)。 然而,产后肝脏 Oxct1 表达的抑制主要是由于表达 Oxct1 的造血祖细胞从肝脏中排出,而不是终末分化肝细胞中先前存在的 Oxct1 表达的丧失。 事实上,Oxct1 mRNA 和 SCOT 蛋白在分化的肝细胞中的表达非常低(Orii 等,2008)。
SCOT 也受 PTM 监管。 该酶在 SIRT3 KO 小鼠的大脑中高度乙酰化,其也表现出 AcAc 依赖性乙酰辅酶 A 产生减少(Dittenhafer-Reed 等人,2015)。 SCOT 酪氨酸残基的非酶硝化也会减弱其活性,这已在各种糖尿病小鼠模型的心脏中得到报道(Marcondes 等人,2001;Turko 等人,2001;Wang 等人,2010a)。 相比之下,色氨酸残基硝化增强了 SCOT 活性(Br�g�re 等人,2010;Rebrin 等人,2007)。 旨在调节SCOT活性的残基特异性硝化或脱硝化的分子机制可能存在并且需要阐明。
肝外生酮的争议
在哺乳动物中,主要的生酮器官是肝脏,只有肝细胞和肠道上皮细胞大量表达 HMGCS2 的线粒体异构体(Cotter 等人,2013a;Cotter 等人,2014;McGarry 和 Foster,1980;Robinson 和 Williamson,1980) . 复杂多糖的厌氧细菌发酵产生丁酸盐,它被哺乳动物的结肠细胞吸收以进行终末氧化或生酮作用(Cherbuy 等人,1995 年),这可能在结肠细胞分化中发挥作用(Wang 等人,2016 年)。 除肠上皮细胞和肝细胞外,几乎所有其他哺乳动物细胞中几乎不存在 HMGCS2,但在肿瘤细胞、中枢神经系统的星形胶质细胞、肾脏、胰腺 ? 细胞、视网膜色素上皮 (RPE) 甚至骨骼肌(Adijanto 等人,2014;Avogaro 等人,1992;El Azzouny 等人,2016;Grabacka 等人,2016;Kang 等人,2015 ;Le Foll 等人,2014;Nonaka 等人,2016;Takagi 等人,2016a;Thevenet 等人,2016;Zhang 等人,2011)。 在缺乏净生酮能力的组织中观察到异位 HMGCS2 (Cook et al., 2016; Wentz et al., 2010),并且 HMGCS2 表现出预期的与生酮无关的“月光”活动,包括在细胞核内 (Chen et al., 2016)。 , 2010 年;Kostiuk 等人,1998 年;Meertens 等人,XNUMX 年)。
任何氧化酮体的肝外组织也有可能通过 HMGCS2 独立机制积累酮体(图 2A)。 然而,没有肝外组织的稳态酮体浓度超过循环中的浓度(Cotter 等人,2011;Cotter 等人,2013b;Harrison 和 Long,1940),这强调了酮体沿着通过 MCT1/2 依赖机制的浓度梯度。 一种明显的肝外生酮机制实际上可能反映了酮氧化的相对损害。 其他可能的解释属于酮体形成领域。 首先,从头生酮可能通过硫解酶和 SCOT 的可逆酶活性发生(Weidemann 和 Krebs,1969)。 当乙酰辅酶 A 的浓度相对较高时,通常负责 AcAc 氧化的反应会以相反的方向进行(GOLDMAN,1954)。 第二种机制发生在 α-氧化衍生的中间体由于 TCA 循环瓶颈而积累时,AcAc-CoA 通过线粒体 3-羟酰基-CoA 脱氢酶催化的反应转化为 L-βOHB-CoA,进一步由 3-羟基丁酰CoA 脱酰基酶生成 l-βOHB,通过质谱或共振光谱无法将其与生理对映异构体 d-βOHB 区分开来(Reed 和 Ozand,1980 年)。 l-?OHB 可以通过色谱或酶法与 d-?OHB 区分开来,并且存在于肝外组织中,但不存在于肝脏或血液中(Hsu 等,2011)。 肝脏生酮仅产生 d-βOHB,这是唯一一种 BDH 底物的对映异构体(Ito 等人,1984;Lincoln 等人,1987;Reed 和 Ozand,1980;Scofield 等人,1982;Scofield 等人, 1982)。 第三种不依赖 HMGCS2 的机制通过氨基酸分解代谢产生 d-βOHB,尤其是亮氨酸和赖氨酸的分解代谢。 第四种机制仅是显而易见的,因为它是由于标记伪影,因此被称为假酮生成。 这种现象归因于SCOT和硫解酶反应的可逆性,并且由于酮体示踪剂在肝外组织中的同位素稀释可能导致酮体周转率的高估(Des Rosiers et al., 1990; Fink et al., 1988) . 尽管如此,在大多数情况下,假酮生成可能可以忽略不计(Bailey 等人,1990;Keller 等人,1978)。 示意图(图 2A)表明了一种有用的方法来应用,同时考虑到酮的组织稳态浓度升高。

� 肾脏作为潜在的生酮器官最近受到关注。 在绝大多数州,肾脏是来自肝脏的酮体的净消耗者,从血液中排泄或再吸收酮体,而肾脏通常不是净酮体生成器或浓缩器(Robinson 和 Williamson,1980)。 一项经典研究的作者得出结论,在人工实验系统中量化的最小肾酮生成与生理学无关(Weidemann 和 Krebs,1969 年)。 最近,已在糖尿病和自噬缺陷小鼠模型中推断出肾生酮,但代谢稳态中的多器官变化更有可能通过多个器官的输入改变综合酮代谢(Takagi 等人,2016a;Takagi 等人, 2016b;张等人,2011)。 最近的一份出版物表明,肾生酮是一种针对肾脏缺血再灌注损伤的保护机制(Tran 等人,2016 年)。 据报道,小鼠肾组织提取物中 ?OHB 的绝对稳态浓度约为 4-12 mM。 为了测试这是否成立,我们量化了进食和 24 小时禁食小鼠肾脏提取物中的 ?OHB 浓度。 禁食 100 小时后,血清 ?OHB 浓度从约 2 μM 增加到 24 mM(图 2B),而肾稳态 ?OHB 浓度在进食状态下约为 100 μM,而在 1 小时禁食状态下仅为 24 mM(图 2)。 45C�E),与 1970 年前量化的浓度一致的观察结果(Hems 和 Brosnan,2014 年)。 在酮症状态下,肝脏来源的酮体可能具有肾脏保护作用,但肾脏生酮的证据需要进一步证实。 RPE 提供了支持真正肝外生酮的有力证据(Adijanto 等人,XNUMX 年)。 这种有趣的代谢转化被认为有可能使 RPE 衍生的酮流向光感受器或 Mller 神经胶质细胞,这可能有助于光感受器外段的再生。
?OHB 作为信号中介
尽管它们能量丰富,但酮体在细胞稳态中发挥着挑衅性的“非典型”信号传导作用(图 3)(Newman 和 Verdin,2014;Rojas-Morales 等,2016)。 例如,?OHB 抑制 I 类 HDAC,增加组蛋白乙酰化,从而诱导抑制氧化应激的基因表达(Shimazu 等,2013)。 ?OHB 本身是禁食或链脲佐菌素诱导的糖尿病小鼠肝脏中赖氨酸残基的组蛋白共价修饰剂(Xie et al., 2016)(另见下文,酮体代谢、翻译后修饰和细胞生理学的整合,以及酮体、氧化应激和神经保护)。
�
?OHB 也是通过 G 蛋白偶联受体的效应器。 通过不清楚的分子机制,它通过 G 蛋白偶联受体 41 (GPR41) 抑制短链脂肪酸信号传导,从而抑制交感神经系统活动并降低总能量消耗和心率(Kimura 等,2011)。 ?OHB 研究最多的信号传导效应之一通过 GPR109A(也称为 HCAR2)进行,它是在脂肪组织(白色和棕色)中表达的羟基羧酸 GPCR 亚家族的成员(Tunaru 等,2003),并且在免疫细胞(Ahmed 等,2009)。 ?OHB 是唯一已知的 GPR109A 受体 (EC50 ~770 µM) 的内源性配体,可被 d-?OHB、l-?OHB 和丁酸盐激活,但不被 AcAc 激活 (Taggart et al., 2005)。 GPR109A 激活的高浓度阈值是通过坚持生酮饮食、饥饿或在酮症酸中毒期间实现的,从而抑制脂肪组织的脂肪分解。 GPR109A 的抗脂解作用通过抑制腺苷酸环化酶和降低 cAMP、抑制激素敏感性甘油三酯脂肪酶来进行(Ahmed 等人,2009;Tunaru 等人,2003)。 这产生了一个负反馈回路,其中酮症通过减少脂肪细胞中非酯化脂肪酸的释放来调节生酮作用(Ahmed et al., 2009; Taggart et al., 2005),这种效应可以通过以下方式抵消刺激脂肪分解的交感神经驱动。 烟酸(维生素 B3,烟酸)是 GRP50A 的有效 (EC0.1 ~ 109 μM) 配体,几十年来一直有效用于治疗血脂异常(Benyo 等人,2005;Benyo 等人,2006;Fabbrini 等人,2010a; Lukasova 等人,2011;Tunaru 等人,2003)。 虽然烟酸增强巨噬细胞中的反向胆固醇转运并减少动脉粥样硬化病变(Lukasova 等,2011),但 ?OHB 对动脉粥样硬化病变的影响仍然未知。 尽管 GPR109A 受体发挥保护作用,并且在中风和神经退行性疾病中使用生酮饮食之间存在有趣的联系(Fu 等人,2015;Rahman 等人,2014),但通过 GPR109A 的 ?OHB 的保护作用尚未在体内得到证实.
最后,?OHB 可能会影响食欲和饱腹感。 一项测量生酮饮食和极低能量饮食影响的研究的荟萃分析得出结论,与对照饮食相比,食用这些饮食的参与者表现出更高的饱腹感(Gibson 等人,2015 年)。 然而,对这种影响的一个合理解释是可能调节食欲的额外代谢或激素元素。 例如,与食物对照喂养的小鼠相比,维持啮齿动物生酮饮食的小鼠表现出增加的能量消耗,尽管卡路里摄入量相似,并且循环瘦素或调节摄食行为的肽基因没有改变(Kennedy 等,2007)。 建议的 ?OHB 抑制食欲的机制包括信号传导和氧化(Laeger et al., 2010)。 昼夜节律基因 (Per2) 的肝细胞特异性缺失和染色质免疫沉淀研究表明,PER2 直接激活 Cpt1a 基因,并间接调节 Hmgcs2,导致 Per2 敲除小鼠的酮症受损 (Chavan et al., 2016)。 这些小鼠表现出对食物的预期受损,通过全身性 ?OHB 给药部分恢复。 未来的研究将需要确认中枢神经系统是直接的?OHB 目标,以及观察到的效果是否需要酮氧化,或者是否涉及其他信号机制。 其他研究人员已经援引下丘脑腹内侧局部星形胶质细胞衍生的生酮作为食物摄入的调节剂的可能性,但这些初步观察也将受益于遗传和基于通量的评估(Le Foll 等,2014)。 酮症和营养缺乏之间的关系仍然很有趣,因为饥饿和饱腹感是减肥失败的重要因素。
酮体代谢、翻译后修饰和细胞生理学的整合
酮体有助于乙酰辅酶 A 的分隔池,这是一种在细胞代谢中表现出突出作用的关键中间体(Pietrocola 等人,2015 年)。 乙酰辅酶 A 的一个作用是作为乙酰化的底物,这是一种酶催化的组蛋白共价修饰(Choudhary 等人,2014;Dutta 等人,2016;Fan 等人,2015;Menzies 等人,2016 )。 计算蛋白质组学研究也出现了大量动态乙酰化线粒体蛋白,其中许多可能通过非酶机制发生(Dittenhafer-Reed 等人,2015;Hebert 等人,2013;Rardin 等人,2013) ;岛津等人,2010)。 赖氨酸脱乙酰酶使用锌辅助因子(例如,核细胞溶质 HDAC)或 NAD+ 作为共底物(sirtuins、SIRT)(Choudhary 等人,2014;Menzies 等人,2016)。 乙酰蛋白质组作为总细胞乙酰辅酶 A 池的传感器和效应器,因为生理和遗传操作都会导致乙酰化的非酶促全局变化(Weinert 等,2014)。 由于细胞内代谢物作为赖氨酸残基乙酰化的调节剂,重要的是要考虑酮体的作用,其丰度是高度动态的。
?OHB 是通过至少两种机制的表观遗传修饰剂。 禁食、热量限制、直接给药或长时间运动引起的 ?OHB 水平升高会引发 HDAC 抑制或组蛋白乙酰转移酶激活(Marosi 等人,2016;Sleiman 等人,2016)或氧化应激(Shimazu 等人,2013) . ?OHB 对 HDAC3 的抑制可以调节新生儿的代谢生理(Rando et al., 2016)。 独立地,?OHB 本身直接修饰组蛋白赖氨酸残基 (Xie et al., 2016)。 长时间禁食或后脲佐菌素诱导的糖尿病酮症酸中毒增加了组蛋白 α-羟基丁酰化。 尽管赖氨酸α-羟基丁酰化和乙酰化位点的数量相当,但在化学计量上观察到组蛋白α-羟基丁酰化比乙酰化更大。 与乙酰化或甲基化相比,组蛋白赖氨酸 α-羟基丁酰化影响不同的基因,表明不同的细胞功能。 α-羟基丁酰化是自发的还是酶促的尚不清楚,但通过酮体动态影响转录,扩大了机制的范围。
热量限制和营养剥夺期间的基本细胞重编程事件可能分别在 SIRT3 和 SIRT5 依赖性线粒体去乙酰化和去琥珀酰化中介导,在肝脏和肝外组织的翻译后水平调节生酮和酮分解蛋白(Dittenhafer-Reed 等人, 2015;Hebert 等人,2013;Rardin 等人,2013;Shimazu 等人,2010)。 尽管占据位点的化学计量比较不一定与代谢通量的变化直接相关,但线粒体乙酰化是动态的,可能由乙酰辅酶 A 浓度或线粒体 pH 值驱动,而不是酶促乙酰转移酶 (Wagner and Payne, 2013)。 SIRT3 和 SIRT5 调节酮体代谢酶的活性引发了酮在塑造乙酰蛋白质组、琥珀酰蛋白质组和其他动态细胞靶标中的相互作用的问题。 事实上,由于酮生成的变化反映了 NAD+ 浓度,酮的产生和丰度可以调节去乙酰化酶活性,从而影响总乙酰辅酶 A/琥珀酰辅酶 A 池、酰基蛋白质组,从而影响线粒体和细胞生理学。 赖氨酸残基的β-羟基丁酰化可以为细胞重编程增加另一层。 在肝外组织中,酮体氧化可能会刺激细胞稳态的类似变化。 虽然乙酰辅酶 A 池的分隔受到高度调节并协调广泛的细胞变化,但酮体直接塑造线粒体和细胞质乙酰辅酶 A 浓度的能力需要阐明(Chen 等人,2012;Corbet 等人, 2016;Pougovkina 等人,2014;Schwer 等人,2009;Wellen 和 Thompson,2012)。 由于乙酰辅酶 A 浓度受到严格调节,并且乙酰辅酶 A 是不透膜的,因此考虑协调乙酰辅酶 A 稳态的驱动机制至关重要,包括 TCA 循环中的生产和末端氧化速率、转化为酮体、线粒体通过肉毒碱乙酰转移酶 (CrAT) 流出,或乙酰辅酶 A 在转化为柠檬酸盐并通过 ATP 柠檬酸裂解酶 (ACLY) 释放后输出到细胞质。 这些后一种机制在细胞乙酰蛋白质组和体内平衡中的关键作用需要对生酮和酮氧化的作用有相匹配的理解(Das 等人,2015;McDonnell 等人,2016;Moussaieff 等人,2015;Overmyer 等人, 2015;Seiler 等人,2014;Seiler 等人,2015;Wellen 等人,2009;Wellen 和 Thompson,2012)。 在基因操作模型的设置中,代谢组学和酰基蛋白质组学的融合技术将需要指定目标和结果。
对酮体的抗炎和促炎反应
酮症和酮体调节炎症和免疫细胞功能,但已经提出了各种甚至不一致的机制。 长期缺乏营养会减少炎症(Youm 等,2015),但 1 型糖尿病的慢性酮症是一种促炎状态(Jain 等,2002;Kanikarla-Marie 和 Jain,2015;Kurepa 等,2012 )。 由于许多免疫系统细胞(包括巨噬细胞或单核细胞)大量表达 GPR109A,因此出现了 ?OHB 在炎症中基于机制的信号传导作用。 虽然 ?OHB 主要发挥抗炎反应(Fu 等人,2014;Gambhir 等人,2012;Rahman 等人,2014;Youm 等人,2015),但高浓度的酮体,尤其是 AcAc,可能引发促炎反应(Jain 等人,2002;Kanikarla-Marie 和 Jain,2015;Kurepa 等人,2012)。
GPR109A 配体在动脉粥样硬化、肥胖、炎症性肠病、神经系统疾病和癌症中的抗炎作用已被综述(Graff 等人,2016 年)。 GPR109A 在糖尿病模型、人类糖尿病患者(Gambhir 等人,2012 年)的 RPE 细胞和神经退行性变期间小胶质细胞中的表达增强(Fu 等人,2014 年)。 RPE 细胞中的 GPR109A 过表达增强了 ?OHB 的抗炎作用,并通过 GPR109A 的药理学抑制或基因敲除消除(Gambhir 等,2012)。 ?OHB 和外源性烟酸 (Taggart et al., 2005) 在 TNF? 中都具有抗炎作用。 或 LPS 通过降低促炎蛋白(iNOS、COX-2)或分泌细胞因子(TNFα、IL-1α、IL-6、CCL2/MCP-1)的水平,部分通过抑制 NF 诱导炎症-?B 易位(Fu 等人,2014;Gambhir 等人,2012)。 ?OHB 降低 ER 应激和 NLRP3 炎性体,激活抗氧化应激反应 (Bae et al., 2016; Youm et al., 2015)。 然而,在神经退行性炎症中,GPR109A 依赖性 ?OHB 介导的保护不涉及炎症介质,如 MAPK 通路信号传导(例如,ERK、JNK、p38)(Fu 等,2014),但可能需要 COX-1 依赖性 PGD2生产(Rahman 等人,2014 年)。 有趣的是,巨噬细胞 GPR109A 需要在缺血性中风模型中发挥神经保护作用(Rahman 等,2014),但 ?OHB 抑制骨髓来源巨噬细胞中 NLRP3 炎性体的能力与 GPR109A 无关(Youm 等., 2015)。 尽管大多数研究将 ?OHB 与抗炎作用联系起来,但 ?OHB 可能是促炎性的并增加小牛肝细胞中脂质过氧化的标志物(Shi 等,2014)。 因此,αOHB 的抗炎作用与促炎作用可能取决于细胞类型、βOHB 浓度、暴露持续时间以及共调节剂的存在与否。
与 ?OHB 不同,AcAc 可以激活促炎信号。 升高的 AcAc,尤其是高葡萄糖浓度时,通过 NADPH 氧化酶/氧化应激依赖性机制加剧内皮细胞损伤(Kanikarla-Marie 和 Jain,2015)。 糖尿病母亲脐带中的高 AcAc 浓度与较高的蛋白质氧化率和 MCP-1 浓度相关(Kurepa 等,2012)。 糖尿病患者的高 AcAc 与 TNF? 表达(Jain 等人,2002)和 AcAc,但不是 ?OHB,在 U1 人单核细胞中诱导 TNF?、MCP-937 表达、ROS 积累和降低的 cAMP 水平(Jain 等人,2002;Kurepa 等人., 2012)。
酮体依赖性信号现象通常仅在酮体浓度高(> 5 mM)时触发,并且在许多研究中,通过不清楚的机制将酮体与促炎或抗炎作用联系起来。 此外,由于 ?OHB 与 AcAc 对炎症的矛盾影响,以及 AcAc/?OHB 比率影响线粒体氧化还原电位的能力,评估酮体对细胞表型的作用的最佳实验比较了 AcAc 和 ? OHB 在不同的比率和不同的累积浓度下 [例如,(Saito et al., 2016)]。 最后,AcAc 只能作为锂盐或乙酯在商业上购买,需要在使用前进行碱水解。 锂阳离子独立诱导信号转导级联反应(Manji 等,1995),AcAc 阴离子不稳定。 最后,使用外消旋 d/l-?OHB 的研究可能会令人困惑,因为只有 d-?OHB 立体异构体可以被氧化成 AcAc,但 d-?OHB 和 l-?OHB 可以各自通过 GPR109A 发出信号,抑制 NLRP3 炎性体,并作为脂肪生成底物。
酮体、氧化应激和神经保护
氧化应激通常被定义为由于过度产生和/或消除受损而导致 ROS 过量呈现的状态。 酮体的抗氧化和氧化应激缓解作用已在体外和体内广泛描述,特别是在神经保护方面。 由于大多数神经元不能有效地从脂肪酸中产生高能磷酸盐,但在碳水化合物供应不足时会氧化酮体,因此酮体的神经保护作用尤为重要(Cahill GF Jr, 2006; Edmond et al., 1987; Yang等人,1987 年)。 在氧化应激模型中,BDH1 诱导和 SCOT 抑制表明酮体代谢可以重新编程以维持不同的细胞信号传导、氧化还原电位或代谢需求(Nagao 等人,2016;Tieu 等人,2003)。
酮体降低细胞损伤、损伤、死亡的等级,并降低神经元和心肌细胞的细胞凋亡(Haces 等人,2008;Maalouf 等人,2007;Nagao 等人,2016;Tieu 等人,2003)。 调用的机制是多种多样的,并不总是与浓度线性相关。 低毫摩尔浓度的 (d 或 l)-?OHB 清除 ROS(羟基阴离子),而 AcAc 清除许多 ROS 物种,但仅在浓度超过生理范围时(IC50 20-67 mM)(Haces 等人,2008 年) . 相反,对电子传输链的氧化还原电位的有益影响是一种通常与 d-?OHB 相关的机制。 虽然所有三种酮体(d/l-βOHB 和 AcAc)都减少了由糖酵解的化学抑制引发的神经元细胞死亡和 ROS 积累,但只有 d-βOHB 和 AcAc 阻止了神经元 ATP 下降。 相反,在体内低血糖模型中,(d 或 l)-αOHB 而不是 AcAc 可防止海马脂质过氧化(Haces 等人,2008;Maalouf 等人,2007;Marosi 等人,2016;Murphy,2009 ; Tieu 等人,2003 年)。 对喂食生酮饮食(87% 千卡脂肪和 13% 蛋白质)的小鼠进行的体内研究显示出抗氧化能力的神经解剖学变化(Ziegler 等,2003),其中海马体中观察到最深刻的变化,谷胱甘肽过氧化物酶和总抗氧化能力。
生酮饮食、酮酯(另见生酮饮食和外源性酮体的治疗用途)或 ?OHB 给药在缺血性中风模型中发挥神经保护作用(Rahman 等人,2014 年); 帕金森病(Tieu 等,2003); 中枢神经系统氧中毒发作(D'Agostino 等人,2013 年); 癫痫痉挛(Yum 等人,2015 年); 线粒体脑肌病、乳酸性酸中毒和中风样 (MELAS) 发作综合征(Frey 等人,2016 年)和阿尔茨海默病(Cunnane 和 Crawford,2003 年;Yin 等人,2016 年)。 相反,最近的一份报告证明了在线粒体 DNA 修复异常的转基因小鼠模型中,生酮饮食导致神经退行性进展的组织病理学证据,尽管线粒体生物合成和抗氧化特征有所增加(Lauritzen 等人,2016 年)。 其他相互矛盾的报告表明,暴露于高浓度酮体会引发氧化应激。 高剂量的 ?OHB 或 AcAc 会导致小牛肝细胞中的一氧化氮分泌、脂质过氧化、SOD、谷胱甘肽过氧化物酶和过氧化氢酶的表达降低,而在大鼠肝细胞中,MAPK 通路的诱导归因于 AcAc 而不是 ?OHB (Abdelmegeed et al., 2004) ; Shi et al., 2014; Shi et al., 2016)。
总之,大多数报告将 ?OHB 与氧化应激的减弱联系起来,因为它的给药抑制 ROS/超氧化物的产生,防止脂质过氧化和蛋白质氧化,增加抗氧化蛋白质水平,并改善线粒体呼吸和 ATP 产生(Abdelmegeed 等,2004; Haces 等人,2008;Jain 等人,1998;Jain 等人,2002;Kanikarla-Marie 和 Jain,2015;Maalouf 等人,2007;Maalouf 和 Rho,2008;Marosi 等人,2016;Tieu等人,2003;尹等人,2016;齐格勒等人,2003)。 虽然 AcAc 比 ?OHB 与氧化应激的诱导更直接相关,但这些影响并不总是容易从预期的促炎反应中分离出来(Jain 等,2002;Kanikarla-Marie 和 Jain,2015;Kanikarla-Marie 和耆那教,2016)。 此外,重要的是要考虑到多效性生酮饮食所赋予的明显抗氧化益处可能不会由酮体本身转导,并且酮体赋予的神经保护可能不完全归因于氧化应激。 例如,在葡萄糖剥夺期间,在皮质神经元葡萄糖剥夺模型中,?OHB 刺激自噬通量并阻止自噬体积累,这与减少神经元死亡有关(Camberos-Luna 等,2016)。 d-?OHB 还可通过抑制 HDAC 前瞻性地诱导经典抗氧化蛋白 FOXO3a、SOD、MnSOD 和过氧化氢酶(Nagao 等人,2016;Shimazu 等人,2013)。
非酒精性脂肪肝(NAFLD)和酮体代谢
肥胖相关的 NAFLD 和非酒精性脂肪性肝炎 (NASH) 是西方国家肝病的最常见原因 (Rinella 和 Sanyal, 2016),而 NASH 诱导的肝功能衰竭是肝移植最常见的原因之一。 虽然仅在肝细胞中过量储存超过 5% 肝重 (NAFL) 的三酰基甘油不会导致肝功能退化,但人类 NAFLD 的进展与全身胰岛素抵抗和 2 型糖尿病风险增加相关,并可能导致心血管疾病和慢性肾脏疾病(Fabbrini 等人,2009;Targher 等人,2010;Targher 和 Byrne,2013)。 NAFLD 和 NASH 的发病机制尚不完全清楚,但包括肝细胞代谢异常、肝细胞自噬和内质网应激、肝免疫细胞功能、脂肪组织炎症和全身炎症介质(Fabbrini 等,2009;Masuoka 和 Chalasani,2013 ;Targher 等人,2010 年;Yang 等人,2010 年)。 碳水化合物、脂质和氨基酸代谢的紊乱发生在人类和模型生物体中并导致肥胖、糖尿病和 NAFLD [综述于 (Farese 等人,2012;Lin 和 Accili,2011;Newgard,2012;Samuel 和舒尔曼,2012 年;孙和拉扎尔,2013 年)]。 虽然在 NAFLD 中通常观察到细胞质脂质代谢中的肝细胞异常(Fabbrini 等,2010b),但在 NAFLD 发病机制中控制脂肪氧化处理的线粒体代谢的作用尚不清楚。 线粒体代谢异常发生在 NAFLD/NASH 发病机制中并促成了 NAFLD/NASH 发病机制(Hyotylainen 等人,2016 年;Serviddio 等人,2011 年;Serviddio 等人,2008 年;Wei 等人,2008 年)。 有一般性(Felig et al., 1974; Iozzo et al., 2010; Koliaki et al., 2015; Satapati et al., 2015; Satapati et al., 2012; Sunny et al., 2011)但不统一( Koliaki 和 Roden,2013 年;Perry 等人,2016 年;Rector 等人,2010 年)一致认为,在真正的 NASH 发展之前,肝线粒体氧化,特别是脂肪氧化,在肥胖、全身性胰岛素抵抗中增强和 NAFLD。 很可能随着 NAFLD 的进展,甚至在单个线粒体中出现氧化能力异质性,最终氧化功能受损(Koliaki 等人,2015;Rector 等人,2010;Satapati 等人,2008;Satapati 等人) ., 2012)。
生酮通常被用作肝脏脂肪氧化的代表。 随着 NAFLD 在动物模型中的进展,酮生成的损害出现,并且可能在人类中出现。 通过不完全确定的机制,高胰岛素血症抑制生酮,与瘦对照相比可能导致低酮血症(Bergman 等人,2007;Bickerton 等人,2008;Satapati 等人,2012;Soeters 等人,2009;Sunny 等人。 ,2011 年;Vice 等人,2005 年)。 尽管如此,循环酮体浓度预测 NAFLD 的能力仍存在争议(M�nnist�等人,2015;Sanyal 等人,2001)。 动物模型中稳健的定量磁共振波谱方法显示,中度胰岛素抵抗时酮转换率增加,但胰岛素抵抗更严重时,酮转换率明显降低(Satapati 等人,2012 年;Sunny 等人,2010 年)。 在患有脂肪肝的肥胖人群中,生酮率是正常的(Bickerton 等人,2008;Sunny 等人,2011),因此,相对于肝细胞内脂肪酸负荷的增加,生酮率降低。 因此,α-氧化衍生的乙酰辅酶A 可能被导向 TCA 循环中的末端氧化、增加末端氧化、磷酸烯醇式丙酮酸驱动的糖异生通过回补/催化反应和氧化应激。 乙酰辅酶 A 也可能以柠檬酸盐的形式从线粒体输出,柠檬酸盐是脂肪生成的前体底物(图 4)(Satapati 等人,2015;Satapati 等人,2012;Solinas 等人,2015)。 虽然酮生成对胰岛素或长期肥胖的禁食反应降低(Satapati 等,2012),但其潜在机制和下游后果仍未完全了解。 最近的证据表明,mTORC1 以一种可能位于胰岛素信号下游的方式抑制酮生成(Kucejova 等人,2016),这与 mTORC1 抑制 PPAR? 介导的 Hmgcs2 诱导的观察结果一致(Sengupta 等人,2010)(另见 HMGCS2 和 SCOT/OXCT1 的调节)。

�
我们小组的初步观察表明生酮不足会对肝脏产生不利影响(Cotter 等人,2014 年)。 为了验证生酮受损的假设,即使在碳水化合物充足和“非生酮”状态下,也会导致葡萄糖代谢异常并引发脂肪性肝炎,我们通过给予反义寡核苷酸 (ASO) Hmgcs2。 标准低脂食物喂养的成年小鼠中 HMGCS2 的损失导致轻度高血糖症并显着增加数百种肝脏代谢物的产生,其中一组强烈表明脂肪生成激活。 对酮生成不足的小鼠进行高脂饮食喂养会导致广泛的肝细胞损伤和炎症。 这些发现支持以下中心假设:(i)生酮不是被动溢出途径,而是肝脏和综合生理稳态的动态节点,(ii)谨慎的生酮增强以减轻 NAFLD/NASH 和肝脏葡萄糖代谢紊乱值得探索.
生酮受损如何导致肝损伤和葡萄糖稳态改变? 首先要考虑的罪魁祸首是生酮通量不足,还是酮体本身。 最近的一份报告表明,酮体可以减轻对 n-3 多不饱和脂肪酸的反应而引起的氧化应激引起的肝损伤(Pawlak 等人,2015 年)。 回想一下,由于肝细胞中缺乏SCOT表达,酮体没有被氧化,但它们可以促进脂肪生成,并发挥多种信号作用,而与它们的氧化无关(另见酮体和 ?OHB 的非氧化代谢命运)信号中介)。 肝细胞衍生的酮体也可能作为肝腺泡内相邻细胞类型的信号和/或代谢物,包括星状细胞和枯否细胞巨噬细胞。 虽然可用的有限文献表明巨噬细胞不能氧化酮体,但这仅使用经典方法测量,并且仅在腹膜巨噬细胞中进行测量(Newsholme 等,1986;Newsholme 等,1987),表明重新考虑到骨髓来源的巨噬细胞中丰富的 SCOT 表达,评估是适当的(Youm 等人,2015)。
肝细胞生酮通量也可能具有细胞保护作用。 虽然有益的机制可能不依赖于生酮本身,但低碳水化合物生酮饮食与 NAFLD 的改善有关(Browning 等,2011;Foster 等,2010;Kani 等,2014;Schugar 和 Crawford,2012) . 我们的观察表明,肝细胞生酮可以反馈和调节 TCA 循环通量、回补通量、磷酸烯醇丙酮酸衍生的糖异生(Cotter 等人,2014),甚至糖原转换。 生酮损伤会导致乙酰辅酶 A 增加 TCA 通量,这与肝脏中 ROS 介导的损伤增加有关(Satapati 等人,2015;Satapati 等人,2012); 迫使碳转化为可以证明具有细胞毒性的从头合成的脂质种类; 并防止 NADH 再氧化为 NAD+(Cotter 等人,2014 年)(图 4)。 总之,未来的实验需要解决相对生酮不足可能变得适应不良、导致高血糖、引发脂肪性肝炎的机制,以及这些机制在人类 NAFLD/NASH 中是否有效。 流行病学证据表明,在脂肪性肝炎的进展过程中,酮生成受损(Embade 等人,2016;Marinou 等人,2011;M�nnist� 等人,2015;Pramfalk 等人,2015;Safaei 等人,2016)增加肝脏生酮的疗法可能是有益的(Degirolamo 等人,2016 年;本田等人,2016 年)。
酮体和心力衰竭 (HF)
心脏代谢率超过 400 kcal/kg/天,ATP 周转率为 6~35 kg/天,是能量消耗和氧化需求最高的器官(Ashrafian et al., 2007; Wang et al., 2010b)。 绝大多数心肌能量周转位于线粒体内,其中 70% 的供应来自粮农组织。 在正常情况下,心脏是杂食性的和灵活的,但病理性重塑的心脏(例如,由于高血压或心肌梗塞)和糖尿病心脏都变得代谢不灵活(Balasse 和 Fery,1989;BING,1954;Fukao 等,2004 ;Lopaschuk 等人,2010;Taegtmeyer 等人,1980;Taegtmeyer 等人,2002;Young 等人,2002)。 事实上,小鼠模型中心脏燃料代谢的基因程序异常会引发心肌病(Carley 等人,2014;Neubauer,2007)。 在生理条件下,正常心脏按其输送的比例氧化酮体,以牺牲脂肪酸和葡萄糖氧化为代价,并且心肌是每单位质量的最高酮体消耗者(BING,1954;Crawford 等,2009;GARLAND 等., 1962; Hasselbaink 等人, 2003; Jeffrey 等人, 1995; Pelletier 等人, 2007; Tardif 等人, 2001; Yan 等人, 2009)。 与脂肪酸氧化相比,酮体的能量效率更高,每投入一分子氧(P/O 比)可产生更多可用于 ATP 合成的能量(Kashiwaya 等人,2010;Sato 等人,1995;Veech,2004) . 酮体氧化也可能产生比FAO更高的能量,保持泛醌被氧化,这提高了电子传递链中的氧化还原跨度,并为合成ATP提供了更多的能量(Sato et al., 1995; Veech, 2004)。 酮体的氧化也可能减少 ROS 的产生,从而减少氧化应激 (Veech, 2004)。
初步的介入性和观察性研究表明酮体在心脏中具有潜在的有益作用。 在实验性缺血/再灌注损伤背景下,酮体具有潜在的心脏保护作用(Al-Zaid 等,2007;Wang 等,2008),可能是由于心脏中线粒体丰度的增加或关键氧化磷酸化的上调调解员(Snorek 等人,2012 年;Zou 等人,2002 年)。 最近的研究表明,在小鼠(Aubert 等,2016)和人类(Bedi 等,2016)的心脏衰竭中,酮体的利用率增加,这支持了先前在人类中的观察结果(BING,1954;Fukao 等,2000; Janardhan 等人,2011;Longo 等人,2004;Rudolph 和 Schinz,1973;Tildon 和 Cornblath,1972)。 心力衰竭患者的循环酮体浓度增加,与充盈压力成正比,观察结果的机制和意义仍然未知(Kupari 等人,1995;Lommi 等人,1996;Lommi 等人,1997;Neely 等人) ., 1972), 但心肌细胞选择性 SCOT 缺乏的小鼠表现出加速的病理性心室重构和 ROS 特征,以响应手术引起的压力过载损伤 (Schugar et al., 2014)。
最近在糖尿病治疗中的有趣观察揭示了心肌酮代谢和病理性心室重塑之间的潜在联系(图 5)。 抑制肾近端肾小管钠/葡萄糖协同转运蛋白 2 (SGLT2i) 通过增加循环酮体浓度增加人类(Ferrannini 等人,2016a;Inagaki 等人,2015)和小鼠(Suzuki 等人,2014)肝脏生酮(Ferrannini 等人,2014;Ferrannini 等人,2016a;Katz 和 Leiter,2015;Mudaliar 等人,2015)。 引人注目的是,这些药物中至少有一种降低了 HF 住院率(例如,如 EMPA-REG OUTCOME 试验所揭示的),并提高了心血管死亡率(Fitchett 等人,2016;Sonesson 等人,2016;Wu 等人,2016a ;Zinman 等人,2015 年)。 虽然有益的 HF 结果与关联的 SGLT2i 背后的驱动机制仍然存在激烈争论,但生存益处可能是多因素的,预期包括酮症,但也对体重、血压、葡萄糖和尿酸水平、动脉僵硬度、交感神经系统、渗透利尿/减少血浆容量,增加血细胞比容(Raz 和 Cahn,2016;Vallon 和 Thomson,2016)。 总而言之,治疗性增加 HF 患者或发生 HF 高风险的酮血症的概念仍然存在争议,但正在临床前和临床研究中进行积极调查(Ferrannini 等人,2016b;Kolwicz 等人, 2016;Lopaschuk 和 Verma,2016;Mudaliar 等人,2016;Taegtmeyer,2016)。
�
癌症生物学中的酮体
酮体与癌症之间的联系正在迅速显现,但对动物模型和人类的研究得出了不同的结论。 由于酮代谢是动态的并且对营养状态有反应,因此追求与癌症的生物学联系是诱人的,因为有可能进行精确指导的营养疗法。 癌细胞经历代谢重编程以维持快速的细胞增殖和生长(DeNicola 和 Cantley,2015;Pavlova 和 Thompson,2016)。 癌细胞代谢中的经典 Warburg 效应源于糖酵解和乳酸发酵在传递能量和补偿对氧化磷酸化的较低依赖性和有限的线粒体呼吸方面的主要作用(De Feyter 等人,2016;Grabacka 等人,2016; Kang 等人,2015;Poff 等人,2014;Shukla 等人,2014)。 葡萄糖碳主要通过糖酵解、戊糖磷酸途径和脂肪生成,它们共同提供肿瘤生物量扩增所需的中间体(Grabacka 等人,2016;Shukla 等人,2014;Yoshii 等人,2015)。 癌细胞通过利用替代燃料来源(包括醋酸盐、谷氨酰胺和天冬氨酸)的能力来适应葡萄糖剥夺(Jaworski et al., 2016; Sullivan et al., 2015)。 例如,限制获取丙酮酸揭示了癌细胞通过羧化将谷氨酰胺转化为乙酰辅酶A的能力,从而维持能量和合成代谢的需求(Yang et al., 2014)。 癌细胞的一个有趣的适应是利用醋酸盐作为燃料(Comerford 等人,2014;Jaworski 等人,2016;Mashimo 等人,2014;Wright 和 Simone,2016;Yoshii 等人,2015)。 醋酸盐也是脂肪生成的底物,这对肿瘤细胞增殖至关重要,并且这种脂肪生成管道的获得与更短的患者生存期和更大的肿瘤负荷相关(Comerford 等人,2014 年;Mashimo 等人,2014 年;Yoshii 等人) ., 2015)。
在葡萄糖剥夺期间,非癌细胞很容易将其能量来源从葡萄糖转移到酮体。 这种可塑性在癌细胞类型中可能更具可变性,但体内植入的脑肿瘤将 [2,4-13C2]-?OHB 氧化到与周围脑组织相似的程度(De Feyter 等,2016)。 “反向 Warburg 效应”或“两室肿瘤代谢”模型假设癌细胞会在相邻的成纤维细胞中诱导 ?OHB 产生,从而满足肿瘤细胞的能量需求(Bonuccelli 等人,2010;Martinez-Outschoorn 等人,2012) . 在肝脏中,肝细胞癌 (hepatoma) 细胞中肝细胞从酮生成向酮氧化的转变与在两种肝癌细胞系中观察到的 BDH1 和 SCOT 活性的激活一致 (Zhang et al., 1989)。 事实上,肝癌细胞表达 OXCT1 和 BDH1 并氧化酮,但仅在血清饥饿时(Huang et al., 2016)。 或者,还提出了肿瘤细胞生酮作用。 生酮基因表达的动态变化表现在结肠上皮的癌变过程中,结肠上皮是一种通常表达 HMGCS2 的细胞类型,最近的一份报告表明 HMGCS2 可能是结直肠癌和鳞状细胞癌预后不良的预后标志物(Camarero 等人, 2006;陈等人,2016)。 这种关联是否需要或涉及生酮,或 HMGCS2 的兼职功能,仍有待确定。 相反,由 PPAR 刺激的黑色素瘤和胶质母细胞瘤细胞明显产生 ?OHB? 激动剂非诺贝特与生长停滞有关(Grabacka 等,2016)。 需要进一步的研究来表征 HMGCS2/SCOT 表达、生酮和酮氧化在癌细胞中的作用。
除了燃料代谢领域,酮最近还通过信号机制与癌细胞生物学有关。 对 BRAF-V600E+ 黑色素瘤的分析表明 OCT1 依赖性诱导 HMGCL 以致癌 BRAF 依赖性方式(Kang 等人,2015)。 HMGCL 增强与更高的细胞 AcAc 浓度相关,这反过来又增强了 BRAFV600E-MEK1 相互作用,在驱动肿瘤细胞增殖和生长的前馈回路中放大 MEK-ERK 信号。 这些观察提出了一个有趣的问题,即预期的肝外生酮,然后支持信号机制(另见 ?OHB 作为信号介质和肝外生酮的争议)。 考虑 AcAc、d-βOHB 和 l-βOHB 对癌症代谢的独立影响也很重要,当考虑 HMGCL 时,亮氨酸分解代谢也可能出现紊乱。
生酮饮食(另见生酮饮食和外源性酮体的治疗用途)在癌症动物模型中的作用各不相同(De Feyter 等人,2016;Klement 等人,2016;Meidenbauer 等人,2015;Poff 等人) .,2014 年;Seyfried 等人,2011 年;Shukla 等人,2014 年)。 虽然肥胖、癌症和生酮饮食之间的流行病学关联存在争议(Liskiewicz 等,2016;Wright 和 Simone,2016),但在动物模型和人体研究中使用生酮饮食的荟萃分析表明,生酮饮食对生存有有益的影响,益处与酮症程度、饮食开始时间和肿瘤位置前瞻性相关(Klement et al., 2016; Woolf et al., 2016)。 用酮体(d-βOHB 或 AcAc)处理胰腺癌细胞可抑制生长、增殖和糖酵解,生酮饮食(81% kcal 脂肪、18% 蛋白质、1% 碳水化合物)可降低体内肿瘤重量、血糖和植入癌症动物的肌肉和体重增加(Shukla 等,2014)。 在饮食中补充酮的小鼠中使用转移性胶质母细胞瘤细胞模型观察到了类似的结果(Poff 等,2014)。 相反,生酮饮食(91% kcal 脂肪,9% 蛋白质)增加循环 ?OHB 浓度并降低血糖,但对荷胶质瘤大鼠的肿瘤体积或存活时间没有影响(De Feyter 等,2016)。 已提出葡萄糖酮指数作为临床指标,可改善人类和小鼠生酮饮食诱导的脑癌治疗的代谢管理(Meidenbauer 等,2015)。 总而言之,酮体代谢和酮体在癌症生物学中的作用是诱人的,因为它们都提供了易于处理的治疗选择,但基本方面仍有待阐明,明确的影响来自变量矩阵,包括 (i) 外源酮之间的差异身体与生酮饮食,(ii)癌细胞类型、基因组多态性、等级和阶段; (iii) 暴露于酮症状态的时间和持续时间。
酮生成是由酮体通过脂肪酸和生酮氨基酸的分解而产生的。 这种生化过程在禁食的情况下为各种器官,特别是大脑提供能量,作为对血糖不可用的反应。 酮体主要在肝细胞的线粒体中产生。 虽然其他细胞能够进行生酮作用,但它们在这样做方面不如肝细胞有效。 因为生酮发生在线粒体中,其过程是独立调节的。 CCST Insight的Alex Jimenez博士
生酮饮食和外源性酮体的治疗应用
生酮饮食和酮体作为治疗工具的应用也出现在非癌症环境中,包括肥胖和 NAFLD/NASH(Browning 等人,2011;Foster 等人,2010;Schugar 和 Crawford,2012); 心力衰竭(Huynh,2016;Kolwicz 等人,2016;Taegtmeyer,2016); 神经和神经退行性疾病(Martin 等人,2016;McNally 和 Hartman,2012;Rho,2015;Rogawski 等人,2016;Yang 和 Cheng,2010;Yao 等人,2011); 先天性代谢错误(Scholl-B�rgi 等,2015); 和运动表现(Cox 等人,2016 年)。 生酮饮食的功效在癫痫发作的治疗中尤其受到重视,特别是在耐药患者中。 大多数研究已经评估了儿科患者的生酮饮食,并显示 50 个月后癫痫发作频率降低了约 3%,并提高了对特定综合征的有效性(Wu 等人,2016b)。 成人癫痫的经验更为有限,但类似的减少是明显的,对有症状的全身性癫痫患者有更好的反应(Nei et al., 2014)。 潜在的抗惊厥作用机制仍不清楚,尽管假设包括葡萄糖利用/糖酵解减少、谷氨酸转运重编程、对 ATP 敏感性钾通道或腺苷 A1 受体的间接影响、钠通道异构体表达的改变或对包括瘦素在内的循环激素的影响。 Lambrechts 等人,2016;Lin 等人,2017;Lutas 和 Yellen,2013)。 目前尚不清楚抗惊厥作用是主要归因于酮体,还是归因于低碳水化合物饮食的级联代谢后果。 尽管如此,酮酯(见下文)似乎提高了诱发癫痫发作动物模型的癫痫发作阈值(Ciarlone 等人,2016;D'Agostino 等人,2013;Viggiano 等人,2015)。
阿特金斯式和生酮低碳水化合物饮食通常被认为令人不快,并可能导致便秘、高尿酸血症、低钙血症、低镁血症、导致肾结石、酮症酸中毒、引起高血糖并提高循环胆固醇和游离脂肪酸浓度(Bisschop 等,2001 ;Kossoff 和 Hartman,2012 年;Kwiterovich 等人,2003 年;铃木等人,2002 年)。 由于这些原因,长期坚持会带来挑战。 啮齿动物研究通常使用独特的常量营养素分布(94% kcal 脂肪、1% kcal 碳水化合物、5% kcal 蛋白质、Bio-Serv F3666),这会引发强烈的酮症。 然而,增加蛋白质含量,即使是 10% kcal 也会大大减少酮症,而 5% kcal 的蛋白质限制会带来混杂的代谢和生理效应。 这种饮食配方也缺乏胆碱,这是另一个影响肝损伤易感性甚至生酮的变量(Garbow 等人,2011;Jornayvaz 等人,2010;Kennedy 等人,2007;Pissios 等人,2013;Schugar等人,2013)。 长期食用生酮饮食对小鼠的影响仍未完全确定,但最近对小鼠的研究表明,尽管氨基酸代谢、能量消耗和胰岛素信号转导,生酮饮食的小鼠在其一生中存活率正常且肝损伤标志物的缺失被显着重新编程(Douris 等人,2015 年)。
通过替代生酮饮食的机制增加酮症的机制包括使用可摄入的酮体前体。 外源性酮体的给药可以创造一种在正常生理学中没有遇到的独特生理状态,因为循环葡萄糖和胰岛素浓度相对正常,而细胞可能会节省葡萄糖的摄取和利用。 酮体本身的半衰期很短,为了达到治疗性酮症而摄入或输注钠 OHB 盐会引起不良的钠负荷。 R/S-1,3-丁二醇是一种无毒的二醇,很容易在肝脏中氧化产生 d/l-αOHB(Desrochers 等,1992)。 在不同的实验环境中,该剂量已每天对小鼠或大鼠给药长达 5 周,在给药后 2 小时内产生高达 3 mM 的循环 ?OHB 浓度,至少在另外 2013 小时内保持稳定(D'阿戈斯蒂诺等人,XNUMX)。 在啮齿动物中观察到给予 R/S-1,3-丁二醇的部分抑制食物摄入(Carpenter 和 Grossman,1983)。 此外,三种化学上不同的酮酯 (KE),(i) R-1,3-丁二醇和 d-αOHB 的单酯 (R-3-羟基丁基 R-αOHB); (ii) 甘油基-三-?OHB; (iii) R,S-1,3-丁二醇乙酰乙酸二酯也得到了广泛研究(Brunengraber,1997;Clarke 等人,2012a;Clarke 等人,2012b;Desrochers 等人,1995a;Desrochers 等人., 1995b; Kashiwaya 等人, 2010)。 前者的固有优势是在肠道或肝脏中酯酶水解后,每摩尔 KE 会产生 2 摩尔生理性 d-βOHB。 安全性、药代动力学和耐受性已在人类摄入 R-3-羟丁基 R-αOHB 中得到最广泛的研究,剂量高达 714 mg/kg,产生高达 6 mM 的循环 d-βOHB 浓度(Clarke 等人, 2012a;Cox 等人,2016;Kemper 等人,2015;Shivva 等人,2016)。 在啮齿动物中,这种 KE 会降低热量摄入和血浆总胆固醇,刺激棕色脂肪组织,并改善胰岛素抵抗(Kashiwaya 等人,2010;Kemper 等人,2015;Veech,2013)。 最近的研究结果表明,在训练有素的运动员运动过程中,摄入 R-3-羟丁基 R-αOHB 会降低骨骼肌糖酵解和血浆乳酸浓度,增加肌内三酰基甘油氧化,并保留肌糖原含量,即使同时摄入碳水化合物会刺激胰岛素分泌。考克斯等人,2016)。 需要进一步发展这些有趣的结果,因为耐力运动表现的改善主要是由 2/8 受试者对 KE 的强烈反应推动的。 尽管如此,这些结果确实支持表明酮氧化优于其他底物的经典研究(GARLAND 等人,1962;Hasselbaink 等人,2003;Stanley 等人,2003;Valente-Silva 等人,2015),包括在运动期间,并且训练有素的运动员可能更容易使用酮(Johnson 等人,1969a;Johnson 和 Walton,1972;Winder 等人,1974;Winder 等人,1975)。 最后,在热量摄入相等(常量营养素之间分布不同)和氧气消耗率相等后,可能支持改善运动表现的机制仍有待确定。
未来展望
曾经在很大程度上被污名为能够在碳水化合物受限状态下积累脂肪燃烧产生的有毒排放物的溢出途径(“酮毒性”范式),最近的观察结果支持了这样一种观点,即即使在富含碳水化合物的状态下,酮体代谢也发挥着有益的作用,从而开启了“酮激素效应”。假设。 虽然控制酮代谢的简便营养和药理学方法使其成为一个有吸引力的治疗靶点,但在基础和转化研究实验室中仍然进行了积极而谨慎的实验。 在定义利用酮代谢在心力衰竭、肥胖、NAFLD/NASH、2 型糖尿病和癌症中的作用的领域中出现了未满足的需求。 酮体的“非规范”信号传导作用的范围和影响,包括调节可能反馈和转发到代谢和信号传导途径的 PTM,需要更深入的探索。 最后,肝外生酮可以打开有趣的旁分泌和自分泌信号机制,并有机会影响神经系统和肿瘤内的共代谢以达到治疗目的。
致谢
Ncbi.nlm.nih.gov/pmc/articles/PMC5313038/
脚注
国家知识产权局
总之,酮体是由肝脏产生的,以便在人体内没有足够的葡萄糖时用作能量来源。 当血液中的葡萄糖水平低时会发生生酮作用,特别是在其他细胞碳水化合物储存耗尽后。 上述文章的目的是讨论酮体在燃料代谢、信号传导和治疗中的多维作用。 我们的信息范围仅限于脊椎按摩疗法和脊柱健康问题。 要讨论主题,请随时询问 Jimenez 博士或通过以下方式联系我们。915-850-0900 。
由Alex Jimenez博士策划
引用自:�Ncbi.nlm.nih.gov/pmc/articles/PMC5313038/
附加主题讨论:急性腰痛
背疼``是全球范围内最普遍的致残原因之一,也是缺勤的原因之一。 背痛是医生就诊的第二常见原因,仅次于上呼吸道感染。 大约80%的人口一生中至少会经历一次背痛。 脊柱是由骨骼,关节,韧带和肌肉以及其他软组织组成的复杂结构。 伤害和/或病情加重,例如。椎间盘突出,最终会导致背部疼痛的症状。 运动伤害或汽车事故伤害通常是造成背痛的最常见原因,但是,有时最简单的动作可能会产生痛苦的结果。 幸运的是,诸如脊椎治疗等替代疗法可以通过使用脊柱调节和手动操作来帮助缓解背部疼痛,最终改善疼痛缓解。
***
by 亚历克斯·希门尼斯博士 | 抗衰老, 排毒, 饮食, 功能医学, 健康管理, 香料类, 整体医学, 自然健康, 营养学, 氧化应激, 补救措施, 补充品, 疗程, 健康
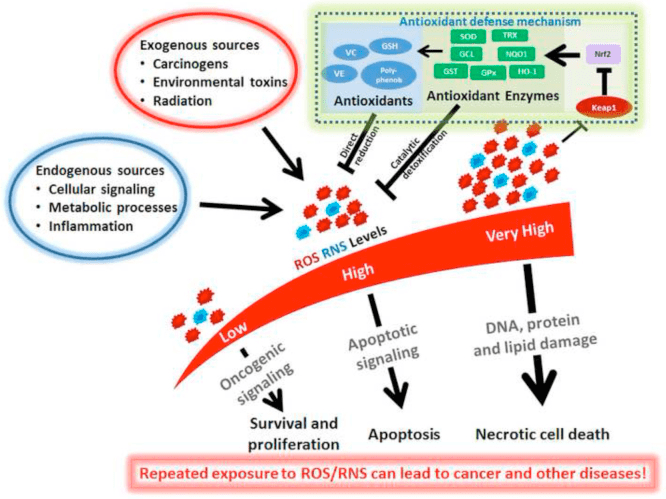
核红细胞2相关因子2信号通路,最广为人知的 Nrf2 是一种保护机制,可作为人体抗氧化反应的“主要调节剂”。 Nrf2 感知细胞内的氧化应激水平并触发保护性抗氧化机制。 虽然 Nrf2 激活有很多好处,但 Nrf2“过度表达”可能有几个风险。
似乎 NRF2 的平衡程度对于预防各种疾病的总体发展以及这些健康问题的总体改善至关重要。 然而,NRF2 也会引起并发症。 NRF2“过度表达”背后的主要原因是基因突变或持续长期暴露于化学或氧化应激等。 下面,我们将讨论 Nrf2 过度表达的缺点并展示其在人体内的作用机制。
癌症预防
研究发现,不表达 NRF2 的小鼠更容易因物理和化学刺激而患上癌症。 然而,类似的研究表明,NRF2 过度激活,甚至 KEAP1 失活,会导致某些癌症的恶化,特别是如果这些途径被中断。 过度活跃的 NRF2 可以通过吸烟发生,其中持续的 NRF2 激活被认为是吸烟者患肺癌的原因。 Nrf2 过表达可能导致癌细胞不会自我毁灭,而间歇性 NRF2 激活可以防止癌细胞触发毒素诱导。
此外,由于 NRF2 过表达增加了人体的抗氧化能力,使其超越氧化还原稳态,这会促进细胞分裂并产生不自然的 DNA 和组蛋白甲基化模式。 这最终会使化疗和放疗对癌症的效果降低。 因此,使用 DIM、木犀草素、紫草或盐霉素等物质限制 NRF2 激活可能是癌症患者的理想选择,尽管不应将 Nrf2 过度激活视为癌症的唯一原因。 营养缺乏会影响基因,包括 NRF2。 这可能是缺陷如何导致肿瘤的一种方式。
肝
Nrf2的过度激活,也会影响人体特定器官的功能。 NRF2 过度表达最终会阻止肝脏产生胰岛素样生长因子 1 或 IGF-1,这对于肝脏的再生至关重要。
胸襟
虽然 Nrf2 的急性过度表达可能有其好处,但 NRF2 的持续过度表达可能会对心脏造成长期的有害影响,例如心肌病。 NRF2 表达可以通过高水平的胆固醇或 HO-1 的激活来增加。 这被认为是慢性胆固醇水平升高可能导致心血管健康问题的原因。
白癜风
NRF2 过表达也已被证明可抑制白癜风的色素沉着能力,因为它可能会阻碍酪氨酸酶或 TYR 的作用,而酪氨酸酶对通过黑色素生成的色素沉着至关重要。 研究表明,这一过程可能是白癜风患者似乎不像没有白癜风的人那样有效地激活 Nrf2 的主要原因之一。
为什么 NRF2 可能无法正常运行
毒物兴奋效应
NRF2 必须被激活才能利用它的好处。 换句话说,Nrf2 不应该每分钟或每天都触发,因此,最好从中休息一下,例如,5 天休息 5 天或每隔一天休息一次。 NRF2 还必须达到一个特定的阈值才能触发其兴奋反应,其中一个小的压力源可能不足以触发它。
DJ-1 氧化
蛋白质去糖酶 DJ-1,或简称 DJ-1,也称为帕金森病蛋白,或 PARK7,是人体氧化还原状态的主要调节器和检测器。 DJ-1 对于调节 NRF2 发挥其功能和产生抗氧化反应的时间长度至关重要。 在 DJ-1 被过度氧化的情况下,细胞会使 DJ-1 蛋白不易接近。
这个过程会导致 NRF2 激活过快过期,因为 DJ-1 对于维持 NRF2 的平衡水平和防止它们在细胞中被分解至关重要。 如果 DJ-1 蛋白不存在或过度氧化,即使使用 DIM 或替代 NRF2 激活剂,NRF2 的表达也可能最小。 DJ-1 表达对于恢复受损的 NRF2 作用是必不可少的。
久病
如果您患有慢性疾病,包括 CIRS、慢性感染/生态失调/SIBO,或重金属堆积,例如汞和/或根管中的重金属,这些可能会阻碍 NRF2 系统和第二阶段解毒。 不是氧化应激将 NRF2 变成抗氧化剂,NRF2 不会触发,氧化应激可以留在细胞中并造成损害,这意味着没有抗氧化反应。 这是许多 CIRS 患者具有多种敏感性并涉及多种因素的重要原因。 有些人认为他们可能会出现 Herx 反应,然而,这种反应可能只会进一步损害细胞。
然而,治疗慢性疾病将允许肝脏将毒素排放到胆汁中,逐渐发展出 NRF2 激活的兴奋反应。 如果胆汁仍然有毒并且没有从人体中排出,它会重新激活 NRF2 的氧化应激,一旦它从胃肠道或胃肠道重新吸收,就会让你感觉更糟。 例如,赭曲霉毒素 A 可能会阻断 NRF2。 除了治疗问题外,组蛋白去乙酰化酶抑制剂可以阻止许多触发 NRF2 激活的因素的氧化反应,但它也可能阻止 NRF2 正常触发,这可能最终无法达到其目的。
鱼油失调
胆碱能药是通过增加乙酰胆碱来促进大脑中乙酰胆碱或乙酰胆碱和胆碱的物质,特别是在抑制乙酰胆碱分解时。 CIRS 患者经常会出现人体内乙酰胆碱水平失调的问题,尤其是在大脑中。 鱼油触发 NRF2,激活其在细胞内的保护性抗氧化机制。
患有慢性疾病的人可能会因有机磷酸盐的积累而出现认知压力和乙酰胆碱兴奋性毒性问题,这可能会导致鱼油在人体内产生炎症。 胆碱缺乏还会诱导 NRF2 活化。 在饮食中加入胆碱(多酚、鸡蛋等)有助于增强胆碱能失调的影响。
什么会降低 NRF2?
减少 NRF2 过度表达最适合患有癌症的人,尽管它可能对各种其他健康问题有益。
饮食、补充剂和常用药物:
- 芹菜素(更高剂量)
- 鸦胆子
- 栗子
- EGCG(高剂量增加 NRF2)
- 胡芦巴(葫芦巴)
- Hiba (Hinokitol / ?-thujaplicin)
- 高盐饮食
- 木犀草素(芹菜、青椒、欧芹、紫苏叶和洋甘菊茶 - 较高剂量可能会增加 NRF2 - 每周 40 次 XNUMX mg/kg 木犀草素)
- 二甲双胍(长期摄入)
- N-乙酰基-L-半胱氨酸(NAC,通过阻断氧化反应,尤其是高剂量)
- 橙皮(含有多甲氧基黄酮类化合物)
- 槲皮素(更高剂量可能会增加 NRF2 – 50 mg/kg/d 槲皮素)
- 盐霉素(药物)
- 视黄醇(全反式视黄酸)
- 维生素 C 与槲皮素合用
- Zi Cao(紫格罗姆维尔有紫草素/Alkannin)
途径和其他:
- Bach1
- BET
- 生物膜
- 芸香醇
- 喜树碱
- DNMT
- 民进党-23
- EZH2
- 糖皮质激素受体信号传导(地塞米松和倍他米松)
- 葛兰素史克-3? (监管反馈)
- HDAC 激活?
- 常山酮
- 同型半胱氨酸(ALCAR 可以逆转这种同型半胱氨酸诱导低水平的 NRF2)
- IL-24的
- 凯普1
- 丙二醛-7
- 核因子B
- 赭曲霉毒素 A(曲霉和青霉属)
- 早幼粒细胞白血病蛋白
- p38
- p53
- p97
- 视黄酸受体α
- 亚硒酸钠
- SYVN1 (Hrd1)
- STAT3 抑制(如隐丹参酮)
- 睾酮(和丙酸睾酮,虽然 TP 鼻内可能会增加 NRF2)
- Trecator(乙硫异烟胺)
- Trx1(通过减少 Keap151 中的 Cys1 或 Nrf506 的 NLS 区域中的 Cys2)
- 特洛克斯
- 伏立诺他
- 锌缺乏(使大脑变得更糟)
Nrf2 作用机制
氧化应激通过 CUL3 触发,其中来自负抑制剂 KEAP2 的 NRF1 随后进入这些细胞的细胞核,刺激 ARE 的转录,将硫化物转化为二硫化物,并将它们转化为更多的抗氧化基因,从而导致抗氧化剂的上调,例如如 GSH、GPX、GST、SOD 等。其余的可以在下面的列表中看到:
- 增加 AKR
- 增加 ARE
- 增加 ATF4
- 增加 Bcl-xL
- 增加 Bcl-2
- 增加 BDNF
- 增加 BRCA1
- 增加 c-Jun
- 增加 CAT
- 增加 cGMP
- 增加 CKIP-1
- 增加CYP450
- 增加 Cul3
- 增加协鑫
- 增加 GCLC
- 增加 GCLM
- 增加 GCS
- 增加GPx
- 增加GR
- 增加谷胱甘肽
- 增加消费税
- 增加 HIF1
- 增加 HO-1
- 提高 HQO1
- 增加 HSP70
- 增加 IL-4
- 增加 IL-5
- 增加 IL-10
- 增加 IL-13
- 增加 K6
- 增加 K16
- 增加 K17
- 增加 mEH
- 增加Mrp2-5
- 增加 NADPH
- 增加缺口 1
- 增加 NQO1
- 增加 PPAR-α
- 增加 Prx
- 增加 p62
- 增加 Sesn2
- 增加 Slco1b2
- 增加 sMaf
- 增加SOD
- 增加 Trx
- 增加 Txn(d)
- 增加 UGT1(A1/6)
- 增加血管内皮生长因子
- 减少 ADAMTS(4/5)
- 减少α-SMA
- 降低 ALT
- 降低 AP1
- 降低 AST
- 减少巴赫1
- 减少 COX-2
- 减少 DNMT
- 减少 FASN
- 减少 FGF
- 减少 HDAC
- 减少 IFN-?
- 降低 IgE
- 减少 IGF-1
- 减少 IL-1b
- 减少 IL-2
- 减少 IL-6
- 减少 IL-8
- 减少 IL-25
- 减少 IL-33
- 减少 iNOS
- 降低 LT
- 减少 Keap1
- 减少 MCP-1
- 减少 MIP-2
- 减少 MMP-1
- 减少 MMP-2
- 减少 MMP-3
- 减少 MMP-9
- 减少 MMP-13
- 减少 NfkB
- 减少 NO
- 减少 SIRT1
- 减少 TGF-b1
- 减少 TNF-α
- 减少酪氨酸
- 减少 VCAM-1
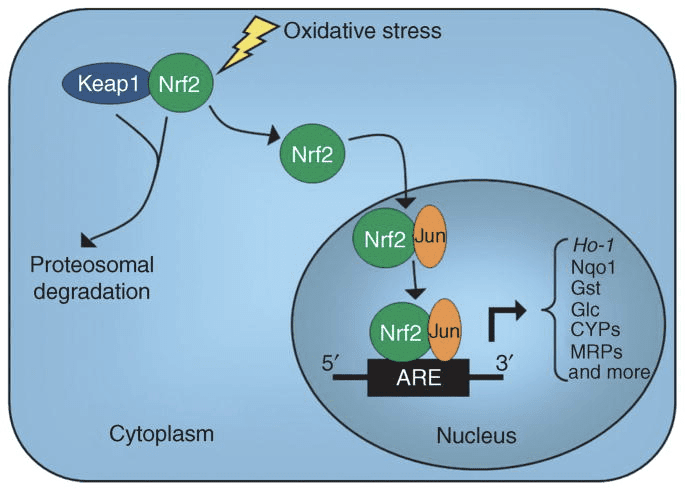
- 由 NFE2L2 基因编码的 NRF2 或核红细胞 2 相关因子 2 是基本亮氨酸拉链或 bZIP 超家族中的转录因子,该超家族利用 Cap'n'Collar 或 CNC 结构。
- 它促进硝酸酶、生物转化酶和外排转运蛋白。
- 它是诱导 II 期抗氧化和解毒酶基因的重要调节剂,可保护细胞免受氧化应激和亲电攻击造成的损害。
- 在稳态条件下,Nrf2 通过 Nrf2 的 N 末端结构域或 Kelch 样 ECH 相关蛋白或 Keap1(也称为 INrf2 或 Nrf2 抑制剂)的身体附着而被隔离在胞质溶胶中,从而抑制 Nrf2 激活。
- 它也可能受哺乳动物硒蛋白硫氧还蛋白还原酶 1 或 TrxR1 的控制,它起负调节作用。
- Nrf2 易受亲电应激源的影响,从 Keap1 解离,转移到细胞核中,然后与一系列转录调节蛋白异二聚化。
- 频繁的相互作用包括与转录权威 Jun 和 Fos 的相互作用,它们可以是转录因子激活蛋白家族的成员。
- 在二聚化后,这些复合物随后与抗氧化剂/亲电反应成分 ARE/EpRE 结合并激活转录,就像 Jun-Nrf2 复合物一样,或者抑制转录,就像 Fos-Nrf2 复合物一样。
- 被触发或抑制的 ARE 的定位将决定哪些基因受这些变量的转录控制。
- 当 ARE 被触发时:
- 激活抗氧化剂的合成能够解毒 ROS 如过氧化氢酶、超氧化物歧化酶或 SOD、GSH-过氧化物酶、GSH-还原酶、GSH-转移酶、NADPH-醌氧化还原酶或 NQO1、细胞色素 P450 单加氧酶系统、硫氧还蛋白、硫氧还蛋白还原酶和 HSP70。
- 这种 GSH 合酶的激活允许 GSH 细胞内程度的显着增长,这是非常具有保护性的。
- 这种合成的增加和 II 期酶的程度,如 UDP-葡糖醛酸基转移酶、N-乙酰转移酶和磺基转移酶。
- HO-1 的上调,它是一种真正的保护性受体,具有潜在的 CO 生长,与 NO 结合允许缺血细胞的血管舒张。
- 通过升高的铁蛋白和胆红素作为亲脂性抗氧化剂来减少铁过载。 II 期蛋白质和抗氧化剂都能够修复慢性氧化应激并恢复正常的氧化还原系统。
- 葛兰素史克3? 在 AKT 和 PI3K 的管理下,磷酸化 Fyn 导致 Fyn 核定位,Fyn 磷酸化 Nrf2Y568 导致核输出和 Nrf2 降解。
- NRF2 还抑制 TH1/TH17 反应并丰富 TH2 反应。
- HDAC 抑制剂通过抑制 Keap2 并鼓励 Keap2 从 Nrf1、Nrf1 核易位和 Nrf1 解离,触发 Nrf1 信号通路并上调 Nrf2 下游靶向 HO-2、NQO2 和谷氨酸-半胱氨酸连接酶催化亚基或 GCLC -ARE 绑定。
- Nrf2 包括在基础条件下约 20 分钟的半衰期。
- 减少 IKK? 池通过 Keap1 绑定减少 I?B? 降解,并且可能是证明 Nrf2 激活抑制 NF?B 激活的难以捉摸的机制。
- Keap1 并不总是必须被下调才能让 NRF2 发挥作用,例如叶绿素、蓝莓、鞣花酸、虾青素和茶多酚可以将 NRF2 和 KEAP1 提高 400%。
- Nrf2 通过硬脂酰辅酶A 去饱和酶或 SCD 和柠檬酸裂解酶或 CL 进行负调控。
基因
KEAP1
rs1048290
- C 等位基因——显示出对耐药性癫痫 (DRE) 的显着风险和保护作用
rs11085735(我是交流电)
地图
rs242561
- T 等位基因——帕金森病的保护性等位基因——具有更强的 NRF2/sMAF 结合,并与大脑 3 个不同区域的更高 MAPT mRNA 水平相关,包括小脑皮层 (CRBL)、颞叶皮层 (TCTX)、小叶内白质 (WHMT)
NFE2L2 (NRF2)
rs10183914(我是CT)
- T 等位基因——Nrf2 蛋白水平升高,帕金森病发病年龄延迟四年
rs16865105(我是交流电)
rs1806649(我是CT)
- C 等位基因 - 已被确定并可能与乳腺癌病因相关。
- 与高 PM10 水平期间住院风险增加有关
rs1962142(我是GG)
- T 等位基因——与细胞质 NRF2 表达水平低(P = 0.036)和硫氧还蛋白阴性表达(P = 0.042)相关
- 一个等位基因——与吸烟状态相关的前臂血流量 (FEV) 下降(一秒内用力呼气量)受到保护(p = 0.004)
rs2001350(我是TT)
- T 等位基因 – 与吸烟状态相关的 FEV0.004 下降(一秒内用力呼气量)受到保护(p = XNUMX)
rs2364722(我是AA)
- 一个等位基因——与吸烟状态相关的 FEV 下降(一秒内用力呼气量)受到保护(p = 0.004)
rs2364723
- C等位基因——与日本肺癌吸烟者的FEV显着降低有关
rs2706110
- G 等位基因——显示出对耐药性癫痫 (DRE) 的显着风险和保护作用
- AA 等位基因——KEAP1 表达显着降低
- AA 等位基因——与乳腺癌风险增加有关(P = 0.011)
rs2886161(我是TT)
rs2886162
- 等位基因 - 与低 NRF2 表达相关(P = 0.011;OR,1.988;CI,1.162-3.400),AA 基因型与较差的生存率相关(P = 0.032;HR,1.687;CI,1.047-2.748)
rs35652124(我是TT)
- A 等位基因 - 与帕金森病发病年龄的相关性更高与 G 等位基因相关
- C等位基因——增加了NRF2蛋白
- T 等位基因——NRF2 蛋白更少,患心脏病和血压的风险更高
rs6706649(我是CC)
- C等位基因——具有较低的NRF2蛋白并增加患帕金森病的风险
rs6721961(我是GG)
- T等位基因——具有较低的NRF2蛋白
- TT等位基因——重度吸烟者吸烟与精液质量下降之间的关联
- TT 等位基因——与乳腺癌风险增加有关 [P = 0.008; 或,4.656; 置信区间 (CI), 1.350-16.063] 和 T 等位基因与低程度的 NRF2 蛋白表达 (P = 0.0003; OR, 2.420; CI, 1.491-3.926) 和负 SRXN1 表达 (P = 0.047; OR, 1.867;CI = 1.002�3.478)
- T 等位基因 - 等位基因名义上也与全身炎症反应综合征后 ALI 相关的 28 天死亡率相关
- T 等位基因 – 与吸烟状态相关的 FEV0.004 下降(一秒内用力呼气量)受到保护(p = XNUMX)
- G 等位基因——与欧洲和非洲裔美国人严重创伤后 ALI 风险增加相关(优势比,OR 6.44;95% 置信区间
- AA 等位基因——与感染诱发的哮喘有关
- AA等位基因——NRF2基因表达显着降低,因此肺癌风险增加,尤其是那些曾经吸烟的人
- AA 等位基因——相对于具有 CC 基因型的那些等位基因,发生 T2DM 的风险显着更高(OR 1.77;95% CI 1.26, 2.49;p = 0.011)
- AA 等位基因 - 伤口修复和辐射的晚期毒性之间的强关联(与高加索人发展趋势的非裔美国人发生晚期效应的风险显着增加相关)
- 与口服雌激素治疗和绝经后妇女静脉血栓栓塞风险相关
rs6726395(我是AG)
- 一个等位基因——与吸烟状态相关的 FEV1 下降(一秒内用力呼气量)受到保护(p = 0.004)
- 一个等位基因——与日本肺癌吸烟者的 FEV1 显着降低有关
- GG 等位基因——具有更高的 NRF2 水平并降低了黄斑变性的风险
- GG等位基因——胆管癌的存活率更高
rs7557529(我是CT)
氧化应激和其他应激源会导致细胞损伤,最终可能导致各种健康问题。 研究表明,Nrf2 激活可以促进人体的保护性抗氧化机制,然而,研究人员已经讨论过 Nrf2 过度表达会对整体健康和健康产生巨大风险。 Nrf2过度激活也会导致各种类型的癌症。
CCST Insight的Alex Jimenez博士
萝卜硫素及其对癌症,死亡率,衰老,大脑和行为,心脏病等的影响
异硫氰酸盐是您可以从饮食中获得的一些最重要的植物化合物。 在本视频中,我为他们提供了迄今为止最全面的案例。 注意时间短? 通过单击以下时间点之一,跳到您喜欢的主题。 完整的时间表如下。
关键部分:
- 00:01:14 –癌症与死亡率
- 00:19:04 –老化
- 00:26:30 –大脑与行为
- 00:38:06 –最终回顾
- 00:40:27 –剂量
完整时间表:
- 00:00:34 –视频中的主要焦点萝卜硫烷的介绍。
- 00:01:14 –十字花科蔬菜的食用和全因死亡率的降低。
- 00:02:12 –前列腺癌的风险。
- 00:02:23 –膀胱癌的风险。
- 00:02:34 –吸烟者罹患肺癌的风险。
- 00:02:48 –患乳腺癌的风险。
- 00:03:13 –假设:如果您已经患有癌症该怎么办? (介入式)
- 00:03:35 –驱动癌症和死亡率相关数据的合理机制。
- 00:04:38 –萝卜硫素和癌症。
- 00:05:32 –动物证据显示西兰花芽提取物对大鼠膀胱肿瘤的发展具有很强的作用。
- 00:06:06 –直接补充萝卜硫烷对前列腺癌患者的影响。
- 00:07:09 –实际乳腺组织中异硫氰酸酯代谢物的生物富集。
- 00:08:32 –抑制乳腺癌干细胞。
- 00:08:53 –历史课:芸苔属被认为具有健康特性,即使在古罗马也是如此。
- 00:09:16 –萝卜硫素增强致癌物质(苯,丙烯醛)排泄的能力。
- 00:09:51 – NRF2是通过抗氧化反应元件进行的遗传开关。
- 00:10:10 – NRF2激活如何通过谷胱甘肽-S-结合物增强致癌物排泄。
- 00:10:34 –抱子甘蓝增加了谷胱甘肽-S-转移酶并减少了DNA损伤。
- 00:11:20 –西兰花芽菜饮料使苯的排泄量增加了61%。
- 00:13:31 –西兰花芽苗匀浆可增加上呼吸道的抗氧化酶。
- 00:15:45 –十字花科蔬菜的食用和心脏病的死亡率。
- 00:16:55 –西兰花芽粉可改善2型糖尿病患者的血脂和心脏病风险。
- 00:19:04 –老化部分的开始。
- 00:19:21 –富含萝卜硫素的饮食可将甲虫的寿命从15%延长至30%(在某些条件下)。
- 时间00:20:34 –低炎症对于延年益寿的重要性。
- 时间00:22:05 –十字花科蔬菜和西兰花芽粉似乎可以减少人类的各种炎症标记。
- 00:23:40 –视频中段回顾:癌症,老龄化部分
- 00:24:14 –小鼠研究表明,萝卜硫烷可能会改善老年患者的适应性免疫功能。
- 时间00:25:18 –萝卜硫素改善了秃顶小鼠模型的毛发生长。 图片在00:26:10。
- 00:26:30 –大脑和行为部分的开始。
- 00:27:18 –西兰花芽提取物对自闭症的影响。
- 时间00:27:48 –葡萄糖尿素对精神分裂症的影响。
- 时间00:28:17 –开始讨论抑郁症(可能的机制和研究)。
- 00:31:21 –使用10种不同的压力诱发抑郁模型进行的小鼠研究显示,萝卜硫烷与氟西汀(百忧解)的疗效相似。
- 00:32:00 –研究表明,直接摄入小鼠中的葡甘露聚糖同样可以有效地预防社交失衡应激模型引起的抑郁症。
- 00:33:01 –神经变性部分开始。
- 00:33:30 –萝卜硫素和阿尔茨海默氏病。
- 00:33:44 –萝卜硫素和帕金森氏病。
- 时间00:33:51 –萝卜硫素和亨廷顿氏病。
- 时间00:34:13 –萝卜硫素增加热休克蛋白。
- 时间00:34:43 –脑外伤部分开始。
- 00:35:01 – TBI后立即注射萝卜硫素可改善记忆力(小鼠研究)。
- 00:35:55 –萝卜硫烷和神经元可塑性。
- 00:36:32 –萝卜硫素改善了II型糖尿病小鼠的学习。
- 时间00:37:19 –萝卜硫素和杜氏肌营养不良症。
- 00:37:44 –肌肉卫星细胞中的Myostatin抑制(体外)。
- 00:38:06 –后期录像回顾:死亡率和癌症,DNA损伤,氧化应激和炎症,苯排泄,心血管疾病,II型糖尿病,对大脑的影响(抑郁,自闭症,精神分裂症,神经退行性变),NRF2途径。
- 时间00:40:27 –关于计算出西兰花芽或萝卜硫素剂量的想法。
- 00:41:01 –在家发芽的轶事。
- 00:43:14 –关于烹饪温度和萝卜硫素活性。
- 时间00:43:45 –肠道细菌从葡糖萝卜素转化为萝卜硫素。
- 时间00:44:24 –补充剂与蔬菜中的活性黑芥子酶结合使用时效果更好。
- 时间00:44:56 –烹饪技巧和十字花科蔬菜。
- 00:46:06 –异硫氰酸酯作为甲状腺激素。
根据研究,Nrf2 是一种基本的转录因子,它可以激活细胞的保护性抗氧化机制,为人体解毒。 然而,Nrf2 的过度表达会导致健康问题。 我们的信息范围仅限于脊椎按摩疗法和脊柱健康问题。 要讨论主题,请随时询问 Jimenez 博士或通过以下方式联系我们。915-850-0900 。
由Alex Jimenez博士策划
附加主题讨论:急性腰痛
背疼``是全球范围内最普遍的致残原因之一,也是缺勤的原因之一。 背痛是医生就诊的第二常见原因,仅次于上呼吸道感染。 大约80%的人口一生中至少会经历一次背痛。 脊柱是由骨骼,关节,韧带和肌肉以及其他软组织组成的复杂结构。 伤害和/或病情加重,例如。椎间盘突出,最终会导致背部疼痛的症状。 运动伤害或汽车事故伤害通常是造成背痛的最常见原因,但是,有时最简单的动作可能会产生痛苦的结果。 幸运的是,诸如脊椎治疗等替代疗法可以通过使用脊柱调节和手动操作来帮助缓解背部疼痛,最终改善疼痛缓解。
***

by 亚历克斯·希门尼斯博士 | 抗衰老, 排毒, 饮食, 功能医学, 健康管理, 香料类, 整体医学, 自然健康, 营养学, 氧化应激, 补救措施, 补充品, 疗程, 健康
目前许多关于癌症的研究已经让卫生专业人员了解身体排毒的方式。 通过分析肿瘤细胞中上调的基因,研究人员发现 核红细胞2相关因子2信号通路,最有名的是 Nrf2。 NRF2是一种重要的转录因子,可激活人体的 保护性抗氧化机制 为了从外部和内部因素调节氧化,以防止氧化应激水平升高。
Nrf2的原理
NRF2 对于维持整体健康至关重要,因为它的主要目的是调节我们如何管理我们每天接触到的一切而不生病。 NRF2 激活在第二阶段解毒系统中发挥作用。第二阶段解毒需要亲脂性或脂溶性自由基并将其转化为亲水性或水溶性物质进行排泄,同时使异常反应的代谢物和化学物质失活第一阶段。
NRF2 激活通过兴奋效应减少人体的整体氧化和炎症。 为了触发 NRF2,必须发生由氧化引起的炎症反应,以便细胞产生适应性反应并产生抗氧化剂,例如谷胱甘肽。 为了打破Nrf2的原理,本质上,氧化应激激活了NRF2,然后激活了人体的抗氧化反应。 NRF2 的功能是平衡氧化还原信号,或细胞中氧化剂和抗氧化剂水平的平衡。
很好地说明了如何通过练习来演示此过程的功能。 通过每次锻炼,肌肉会适应,以便它可以适应另一次锻炼。 如果 NRF2 因慢性感染或毒素暴露增加而表达不足或过度表达,这可能在患有慢性炎症反应综合征或 CIRS 的患者中观察到,那么在 NRF2 激活后,健康问题可能会恶化。 最重要的是,如果 DJ-1 被过度氧化,NRF2 的激活将很快结束。
NRF2激活的影响
NRF2 激活在肺、肝和肾中高度表达。 核红细胞 2 相关因子 2,或 NRF2,最常见的功能是抵消人体中可导致氧化应激的氧化水平升高。 Nrf2 激活可以帮助治疗各种健康问题,但是,Nrf2 的过度激活可能会恶化各种问题,如下所示。
定期激活 Nrf2 有助于:
- 老化(即长寿)
- 自身免疫和整体炎症(即关节炎、自闭症)
- 癌症和化学保护(即 EMF 暴露)
- 抑郁和焦虑(即创伤后应激障碍)
- 药物暴露(酒精、非甾体抗炎药)
- 运动和耐力表现
- 肠道疾病(即 SIBO、营养不良、溃疡性结肠炎)
- 肾病(即急性肾损伤、慢性肾病、狼疮肾炎)
- 肝病(即酒精性肝病、急性肝炎、非酒精性脂肪肝、非酒精性脂肪性肝炎、肝硬化)
- 肺部疾病(即哮喘、纤维化)
- 代谢和血管疾病(即动脉粥样硬化、高血压、中风、糖尿病)
- 神经退行性变(即阿尔茨海默病、帕金森病、亨廷顿病和 ALS)
- 疼痛(即神经病)
- 皮肤病(即牛皮癣、UVB/防晒)
- 毒素暴露(砷、石棉、镉、氟化物、草甘膦、汞、败血症、烟雾)
- 视力(即强光、敏感、白内障、角膜营养不良)
Nrf2 的过度激活会恶化:
- 动脉粥样硬化
- 癌症(即脑癌、乳腺癌、头癌、颈癌、前列腺癌、肝癌、甲状腺癌)
- 慢性炎症反应综合征 (CIRS)
- 心脏移植(虽然开放的 NRF2 可能不好,但 NRF2 可以帮助修复)
- 丙型肝炎
- 肾炎(重症)
- 白癜风
此外,NRF2 可以帮助使特定的营养补充剂、药物和药物发挥作用。 许多天然补充剂也可以帮助触发 NRF2。 通过目前的研究,研究人员已经证明,大量曾经被认为是抗氧化剂的化合物实际上是促氧化剂。 这是因为几乎所有人都需要 NRF2 才能发挥作用,即使是姜黄素和鱼油等补充剂。 例如,可可被证明可以在拥有 NRF2 基因的小鼠中产生抗氧化作用。
激活 NRF2 的方法
在阿尔茨海默病、帕金森病、中风甚至自身免疫性疾病等神经退行性疾病的情况下,上调 Nrf2 可能是最好的,但要以兴奋的方式进行。 混合 NRF2 激活剂也可能具有累加或协同作用,因为有时它可能是剂量依赖性的。 下面列出了增加 Nrf2 表达的主要方法:
- HIST(锻炼)+ CoQ10 + 太阳(这些协同作用非常好)
- 西兰花芽 + LLLT 在我的头和肠子上
- 丁酸盐 + 超级咖啡 + 晨光
- 针灸(这是另一种方法,也可以使用激光针灸)
- 禁食
- 大麻二酚(CBD)
- 狮子鬃毛 + 褪黑激素
- α-硫辛酸 + DIM
- 蒿
- PPAR-γ激活
以下综合列表包含超过 350 种通过饮食、生活方式和设备、益生菌、补充剂、草药和油、激素和神经递质、药物/药物和化学品、途径/转录因子以及其他方式激活 Nrf2 的其他方法,仅关于什么可以触发 Nrf2 的简要指南。 为简洁起见,我们省略了 500 多种其他有助于激活 Nrf2 的食物、营养补充剂和化合物。 下面列出了以下内容:
饮食:
- 阿萨伊浆果
- 酒精(红酒更好,尤其是如果有软木塞,因为软木塞中的原儿茶醛也可以激活 NRF2。一般来说,不建议饮酒,虽然急性摄入会增加 NRF2。长期摄入可能会降低 NRF2。
- 藻类(海带)
- 苹果
- 红茶
- 巴西坚果
- 西兰花芽菜(和其他异硫氰酸盐、萝卜硫素以及十字花科蔬菜,如含有 D3T 的白菜)
- 蓝莓(0.6-10 克/天)
- 胡萝卜(falcarinone)
- 辣椒(辣椒素)
- 芹菜(丁苯酞)
- 白桦茸(白桦茸)
- 甘菊茶
- 嘉
- 中国土豆
- 苦莓(野樱莓)
- 巧克力(深色或可可)
- 肉桂
- 咖啡(如绿原酸、咖啡醇和咖啡豆)
- 冬虫夏草
- 鱼(和贝类)
- 亚麻籽
- 大蒜
- 酥油(可能)
- 姜(和小豆蔻)
- 枸杞
- 葡萄柚(柚皮素 – 50 mg/kg/d 柚皮素)
- 葡萄
- 绿茶
- 番石榴
- 棕榈之心
- 羊栖菜/裙带菜
- 蜂窝
- 奇异果
- 豆
- 狮子的鬃毛
- 马虎娃
- 芒果(芒果苷)
- 罗汉果
- 牛奶(山羊、奶牛——通过微生物组的调节)
- 桑葚
- 橄榄油(果渣——羟基酪醇和齐墩果酸)
- 欧米茄 6 脂肪酸(脂氧素 A4)
- 奥桑奇橙子(莫林)
- 牡蛎蘑菇
- 番木瓜
- 花生米
- 鸽豆豆
- 石榴(Punicalagin,鞣花酸)
- 蜂胶(松柏素)
- 紫薯
- 红毛丹(天竺葵)
- 葱
- 灵芝
- 红景天(红景天苷)
- 米糠(环青蒿素阿魏酸盐)
- 米莓
- Rooibos茶
- 迷迭香
- 圣人
- 红花
- 香油
- 大豆(和异黄酮、黄豆苷元、染料木素)
- 壁球
- 草莓
- 苦荞麦
- 麝香草
- 蕃茄
- 黑香豆
- 姜黄
- 山葵
- 西瓜
生活方式和设备:
- 针灸和电针(通过 ECM 上的胶原蛋白级联)
- 蓝光
- 脑力游戏(增加海马体中的 NRF2)
- 热量限制
- 冷(淋浴、跳水、冰浴、装备、冷冻疗法)
- EMF(低频,例如 PEMF)
- 运动(HIST 或 HIIT 等急性运动似乎更有利于诱导 NRF2,而较长时间的运动不会诱导 NRF2,但会增加谷胱甘肽水平)
- 高脂肪饮食(饮食)
- 高温(桑拿)
- 氢气吸入和氢气水
- 高压氧治疗
- 红外线疗法(如 Joovv)
- 静脉注射维生素C
- 生酮饮食
- 臭氧
- 吸烟(不推荐——急性吸烟会增加 NRF2,长期吸烟会降低 NRF2。如果您选择吸烟,圣罗勒可能有助于防止 NRF2 下调)
- 太阳(UVB 和红外线)
益生菌:
- 枯草芽孢杆菌 (fmbJ)
- 丁酸梭菌 (MIYAIRI 588)
- 短乳杆菌
- 干酪乳杆菌(SC4 和 114001)
- 胶状乳杆菌
- 格氏乳杆菌(OLL2809、L13-Ia 和 SBT2055)
- 瑞士乳杆菌 (NS8)
- 副干酪乳杆菌 (NTU 101)
- 植物乳杆菌(C88、CAI6、FC225、SC4)
- 鼠李糖乳杆菌(GG)
补充剂、草药和油:
- 乙酰左旋肉碱 (ALCAR) 和肉碱
- 大蒜素
- α-硫辛酸
- 黄酮
- 穿心莲
- 丁胺
- 芹菜素
- 精氨酸
- 朝鲜蓟(氰基)
- Ashwaganda
- 黄芪
- 假马齿苋
- 牛排(Isogemaketone)
- 小檗碱
- β-石竹
- 鬼针草属植物
- 黑孜然油(百里醌)
- 乳香
- 布泰因
- 丁酸
- 大麻二酚(CBD)
- 类胡萝卜素(如 β-胡萝卜素 [与番茄红素的协同作用 – 2 × 15 mg/d 番茄红素]、岩藻黄质、玉米黄质、虾青素和叶黄素)
- 奇特拉克
- 小球藻
- 叶绿素
- 菊花
- 肉桂
- 常见的茅膏菜
- 铜
- 黄连
- CoQ10
- 姜黄素
- 达米阿
- 丹神/红鼠尾草(Miltirone)
- DIM
- 薯蓣皂甙
- 东陵草
- 当归(女参)
- 埃克洛尼亚卡瓦酒
- EGCG
- 土木香 / 旋覆花
- 杜仲皮
- 阿魏酸
- 漆黄素
- 鱼油(DHA/EPA – 3 × 1 g/d 鱼油,含 1098 mg EPA 和 549 mg DHA)
- 高良姜
- 天麻素(天麻)
- 龙胆属
- 天竺葵
- 银杏叶(银杏内酯 B)
- 玻璃草
- 积雪草
- 葡萄籽提取物
- 毛仙草
- 哈里塔基(Triphala)
- 山楂
- 蜡菊
- 指甲花(胡桃)
- 槿
- 去甲乌药碱
- 圣罗勒/图尔西(熊果酸)
- 酒花
- 角质山羊杂草(淫羊藿苷/淫羊藿苷)
- 靛蓝
- 铁(除非必要,否则不推荐)
- I3C
- 约伯的眼泪
- 辣木(如山奈酚)
- Inchinkoto(知子和艾草的组合)
- 葛根
- 甘草
- 林德拉根
- 木犀草素(高剂量激活,低剂量抑制癌症中的 NRF2)
- 玉兰
- 曼吉斯塔
- Maximowiczianum(Acerogenin A)
- 墨西哥山金车
- 水飞蓟
- 美图Q
- 木香
- 刺毛黧豆
- 烟酰胺和 NAD+
- 人参
- 西番莲(如 Chrysin,但 chyrisin 也可能通过 PI2K/Akt 信号传导失调降低 NRF3)
- Pau d�arco(拉帕乔)
- 根皮素
- 白皮杉醇
- PQQ
- 原花青素
- 紫檀芪
- 葛根
- 槲皮素(仅高剂量,低剂量抑制 NRF2)
- 火强
- 红三叶草
- 白藜芦醇(主要是 Piceid 和其他植物雌激素,虎杖)
- 口嚼片
- 红木
- 芦丁
- 苏木
- 沙士
- 三白草
- SC-E1(石膏、茉莉、甘草、葛根和气球花)
- 五味子
- 自愈(夏枯草)
- Skullcap(黄芩苷和 Wogonin)
- 羊酸模
- 四物堂
- 铁皮炎
- 斯派克纳德(龙牙)
- 螺旋藻
- 圣约翰草
- 萝卜硫素
- 萨瑟兰迪亚
- 陶红思舞
- 牛磺酸
- 雷神藤(雷公藤)
- 生育酚(如维生素 E 或芳樟醇)
- 刺蒺藜
- 土司子
- 杜卡
- 维生素 A(虽然其他类视黄醇会抑制 NRF2)
- 维生素 C(仅限高剂量,低剂量会抑制 NRF2)
- 荆条/贞洁树
- 白牡丹(来自芍药的芍药苷)
- 艾草(Hispidulin 和青蒿素)
- 逍遥丸(逍遥游)
- Yerba Santa(圣草)
- 袁志(Tenuigenin)
- 子草(会减少癌症中的 NRF2)
- 锌
- 枣
激素和神经递质:
- 脂联素
- 阿卓平
- 雌激素(但可能会降低乳房组织中的 NRF2)
- 褪黑激素
- 黄体激素
- 喹啉酸(用于防止兴奋性毒性的保护性反应)
- 羟色胺
- T3 等甲状腺激素(可以增加健康细胞中的 NRF2,但在癌症中减少它)
- 维生素D
药物/药物和化学品:
- 对乙酰氨基酚
- 乙酰唑胺
- 氨氯地平
- 金诺芬
- 甲基巴多索隆 (BARD)
- 苯硝唑
- BHA
- CDDO-咪唑啉
- 头孢曲松(和β-内酰胺类抗生素)
- 西力士
- 地塞米松
- 地普利芬(异丙酚)
- 雌三醇
- 艾塞那肽4
- 依泽替米贝
- 氟化物
- 富马酸
- HNE(氧化)
- 咪唑生
- 无机砷和亚砷酸钠
- JQ1(也可能抑制 NRF2,未知)
- 莱泰里斯
- 马法兰
- 醋甲唑胺
- 亚甲蓝
- 硝苯地平
- NSAIDs的
- 吡噻
- PPI(如奥美拉唑和兰索拉唑)
- Protandim——体内效果很好,但在激活人体 NRF2 时效果很弱/不存在
- 普罗布考
- 雷帕霉素
- 利血平
- 钌
- 西他赛坦
- 他汀类药物(如立普妥和辛伐他汀)
- 他莫昔芬
- 唐洛宁
- 苯甲酸
- Tecfidera(富马酸二甲酯)
- THC(不如 CBD 强)
- 茶碱
- 伞形酮
- 熊去氧胆酸 (UDCA)
- 维拉帕米
- 伟哥
- 4-乙酰氧基苯酚
途径/转录因子:
- ?7 nAChR 激活
- AMPK
- 胆红素
- CDK20
- CKIP-1
- CYP2E1
- EAAT
- 甘基林
- 小鬼
- GJA1
- H-铁蛋白亚铁氧化物酶
- HDAC 抑制剂(如丙戊酸和 TSA,但会导致 NRF2 不稳定)
- 热休克蛋白
- IL-17的
- IL-22的
- 克洛托
- let-7(击倒 mBach1 RNA)
- MAPK
- 迈克尔接受者(大多数)
- 和平号空间站141
- 和平号空间站153
- miR-155(也可以击倒 mBach1 RNA)
- miR-7(在大脑中,有助于癌症和精神分裂症)
- 缺口1
- 氧化应激(如 ROS、RNS、H2O2)和亲电体
- PGC-1?
- PKC-δ
- PPAR-γ(协同效应)
- Sigma-1 受体抑制
- SIRT1(增加大脑和肺部的 NRF2,但可能整体降低)
- SIRT2
- SIRT6(在肝脏和大脑中)
- SRXN1
- TrxR1 抑制(衰减或耗尽)
- 锌原卟啉
- 4-HHE
其他:
- 黄素
- 石棉
- 鸟霉素
- 解淀粉芽孢杆菌(用于农业)
- 一氧化碳
- 瑞香
- 谷胱甘肽耗尽(可能耗尽 80%~90%)
- 朝鲜体操运动员
- 丙型肝炎
- 疱疹(HSV)
- 印度白蜡树
- 靛蓝根
- 异沙利浦苷
- 异鼠李素
- 红曲霉素
- Omaveloxolone(强,又名 RTA-408)
- PDTC
- 硒缺乏症(硒缺乏会增加NRF2)
- 西伯利亚落叶松
- 槐花黄酮G
- 忠萩三叉戟
- 香椿 (7-DGD)
- 喇叭花
- 63171 和 63179(强)
核红细胞 2 相关因子 2 信号通路,以首字母缩略词 Nrf2 最为人所知,是一种转录因子,在调节人体的保护性抗氧化机制,特别是为了控制氧化应激方面发挥着重要作用。 虽然增加的氧化应激水平可以激活 Nrf2,但通过特定化合物的存在,其效果会大大增强。 某些食物和补充剂有助于激活人体内的 Nrf2,包括 异硫氰酸酯萝卜硫素 来自西兰花芽。 CCST Insight的Alex Jimenez博士
萝卜硫素及其对癌症,死亡率,衰老,大脑和行为,心脏病等的影响
异硫氰酸盐是您可以从饮食中获得的一些最重要的植物化合物。 在本视频中,我为他们提供了迄今为止最全面的案例。 注意时间短? 通过单击以下时间点之一,跳到您喜欢的主题。 完整的时间表如下。
关键部分:
- 00:01:14 –癌症与死亡率
- 00:19:04 –老化
- 00:26:30 –大脑与行为
- 00:38:06 –最终回顾
- 00:40:27 –剂量
完整时间表:
- 00:00:34 –视频中的主要焦点萝卜硫烷的介绍。
- 00:01:14 –十字花科蔬菜的食用和全因死亡率的降低。
- 00:02:12 –前列腺癌的风险。
- 00:02:23 –膀胱癌的风险。
- 00:02:34 –吸烟者罹患肺癌的风险。
- 00:02:48 –患乳腺癌的风险。
- 00:03:13 –假设:如果您已经患有癌症该怎么办? (介入式)
- 00:03:35 –驱动癌症和死亡率相关数据的合理机制。
- 00:04:38 –萝卜硫素和癌症。
- 00:05:32 –动物证据显示西兰花芽提取物对大鼠膀胱肿瘤的发展具有很强的作用。
- 00:06:06 –直接补充萝卜硫烷对前列腺癌患者的影响。
- 00:07:09 –实际乳腺组织中异硫氰酸酯代谢物的生物富集。
- 00:08:32 –抑制乳腺癌干细胞。
- 00:08:53 –历史课:芸苔属被认为具有健康特性,即使在古罗马也是如此。
- 00:09:16 –萝卜硫素增强致癌物质(苯,丙烯醛)排泄的能力。
- 00:09:51 – NRF2是通过抗氧化反应元件进行的遗传开关。
- 00:10:10 – NRF2激活如何通过谷胱甘肽-S-结合物增强致癌物排泄。
- 00:10:34 –抱子甘蓝增加了谷胱甘肽-S-转移酶并减少了DNA损伤。
- 00:11:20 –西兰花芽菜饮料使苯的排泄量增加了61%。
- 00:13:31 –西兰花芽苗匀浆可增加上呼吸道的抗氧化酶。
- 00:15:45 –十字花科蔬菜的食用和心脏病的死亡率。
- 00:16:55 –西兰花芽粉可改善2型糖尿病患者的血脂和心脏病风险。
- 00:19:04 –老化部分的开始。
- 00:19:21 –富含萝卜硫素的饮食可将甲虫的寿命从15%延长至30%(在某些条件下)。
- 时间00:20:34 –低炎症对于延年益寿的重要性。
- 时间00:22:05 –十字花科蔬菜和西兰花芽粉似乎可以减少人类的各种炎症标记。
- 00:23:40 –视频中段回顾:癌症,老龄化部分
- 00:24:14 –小鼠研究表明,萝卜硫烷可能会改善老年患者的适应性免疫功能。
- 时间00:25:18 –萝卜硫素改善了秃顶小鼠模型的毛发生长。 图片在00:26:10。
- 00:26:30 –大脑和行为部分的开始。
- 00:27:18 –西兰花芽提取物对自闭症的影响。
- 时间00:27:48 –葡萄糖尿素对精神分裂症的影响。
- 时间00:28:17 –开始讨论抑郁症(可能的机制和研究)。
- 00:31:21 –使用10种不同的压力诱发抑郁模型进行的小鼠研究显示,萝卜硫烷与氟西汀(百忧解)的疗效相似。
- 00:32:00 –研究表明,直接摄入小鼠中的葡甘露聚糖同样可以有效地预防社交失衡应激模型引起的抑郁症。
- 00:33:01 –神经变性部分开始。
- 00:33:30 –萝卜硫素和阿尔茨海默氏病。
- 00:33:44 –萝卜硫素和帕金森氏病。
- 时间00:33:51 –萝卜硫素和亨廷顿氏病。
- 时间00:34:13 –萝卜硫素增加热休克蛋白。
- 时间00:34:43 –脑外伤部分开始。
- 00:35:01 – TBI后立即注射萝卜硫素可改善记忆力(小鼠研究)。
- 00:35:55 –萝卜硫烷和神经元可塑性。
- 00:36:32 –萝卜硫素改善了II型糖尿病小鼠的学习。
- 时间00:37:19 –萝卜硫素和杜氏肌营养不良症。
- 00:37:44 –肌肉卫星细胞中的Myostatin抑制(体外)。
- 00:38:06 –后期录像回顾:死亡率和癌症,DNA损伤,氧化应激和炎症,苯排泄,心血管疾病,II型糖尿病,对大脑的影响(抑郁,自闭症,精神分裂症,神经退行性变),NRF2途径。
- 时间00:40:27 –关于计算出西兰花芽或萝卜硫素剂量的想法。
- 00:41:01 –在家发芽的轶事。
- 00:43:14 –关于烹饪温度和萝卜硫素活性。
- 时间00:43:45 –肠道细菌从葡糖萝卜素转化为萝卜硫素。
- 时间00:44:24 –补充剂与蔬菜中的活性黑芥子酶结合使用时效果更好。
- 时间00:44:56 –烹饪技巧和十字花科蔬菜。
- 00:46:06 –异硫氰酸酯作为甲状腺激素。
根据目前的许多研究,核红细胞 2 相关因子 2 信号通路,最广为人知的是 Nrf2,是一种基本的转录因子,可激活细胞的保护性抗氧化机制,使人体免受外部和内部因素的影响,并防止增加氧化应激水平。 我们的信息范围仅限于脊椎按摩疗法和脊柱健康问题。 要讨论该主题,请随时询问 Jimenez 博士或通过以下方式联系我们。915-850-0900 。
由Alex Jimenez博士策划
附加主题讨论:急性腰痛
背疼``是全球范围内最普遍的致残原因之一,也是缺勤的原因之一。 背痛是医生就诊的第二常见原因,仅次于上呼吸道感染。 大约80%的人口一生中至少会经历一次背痛。 脊柱是由骨骼,关节,韧带和肌肉以及其他软组织组成的复杂结构。 伤害和/或病情加重,例如。椎间盘突出,最终会导致背部疼痛的症状。 运动伤害或汽车事故伤害通常是造成背痛的最常见原因,但是,有时最简单的动作可能会产生痛苦的结果。 幸运的是,诸如脊椎治疗等替代疗法可以通过使用脊柱调节和手动操作来帮助缓解背部疼痛,最终改善疼痛缓解。
***
by 亚历克斯·希门尼斯博士 | 抗衰老, 慢性疼痛, 排毒, 饮食, 功能医学, 健康管理, 香料类, 整体医学, 自然健康, 营养学, 氧化应激, 补救措施, 补充品, 疗程, 健康
氧化应激是导致各种健康问题发展的主要因素,包括癌症,心脏病,糖尿病,加速衰老和神经退行性疾病。 富含抗氧化剂的食物,草药和补品可用于保护人体免受高水平的氧化应激。 最近的研究表明, Nrf2基因途径 可以帮助增强抗氧化剂的作用。 这 Nrf2的好处 如下所述。
保护身体免受毒素侵害
NRF2是一种内在物质,可以保护细胞免受有害的内部和外部化合物的侵害。 NRF2 可能有助于丰富人体对药物/药物和毒素的反应,改善有助于消除细胞中化合物的蛋白质的产生,称为多药耐药相关蛋白或 MRP。举例来说,NRF2 被触发吸入香烟烟雾,让肺部排毒。
此外,肺部必须保护自己免受过敏原、病毒性疾病、细菌内毒素、高氧和各种环境污染物的侵害。 然而,Nrf2 的持续触发可以降低整个人体中称为谷胱甘肽的物质的水平。 NRF2 还可以保护肝脏免受毒性,它可以保护肝脏免受砷的肝毒性。 此外,NRF2 保护肝脏和大脑免受酒精消耗。 例如,Nrf2 可以防止对乙酰氨基酚的毒性。
抵抗炎症和氧化应激
NRF2激活可通过减少炎症细胞因子(如牛皮癣中存在的炎症因子)来帮助对抗炎症。 NRF2还可以减少与各种健康问题相关的炎症,例如关节炎和肝,肾和肺纤维化。 NRF2还可以通过降低Th1 / Th17细胞因子和提高TH2细胞因子来帮助控制过敏。 这对于哮喘等疾病可能是有益的。
NRF2 还可以保护细胞免受蓝光和阳光中的 UVA/UVB 的伤害。 Nrf2 缺陷会使晒伤变得容易得多。 这背后的一个基本原理是因为 NRF2 能够调节胶原蛋白以响应紫外线辐射。 高级糖基化终产物或 AGE 会导致许多健康问题的发展,包括糖尿病和神经退行性疾病。 NRF2可以降低体内AGEs的氧化应激。 NRF2 还可以保护人体免受更高水平的热应激。
增强线粒体和运动表现
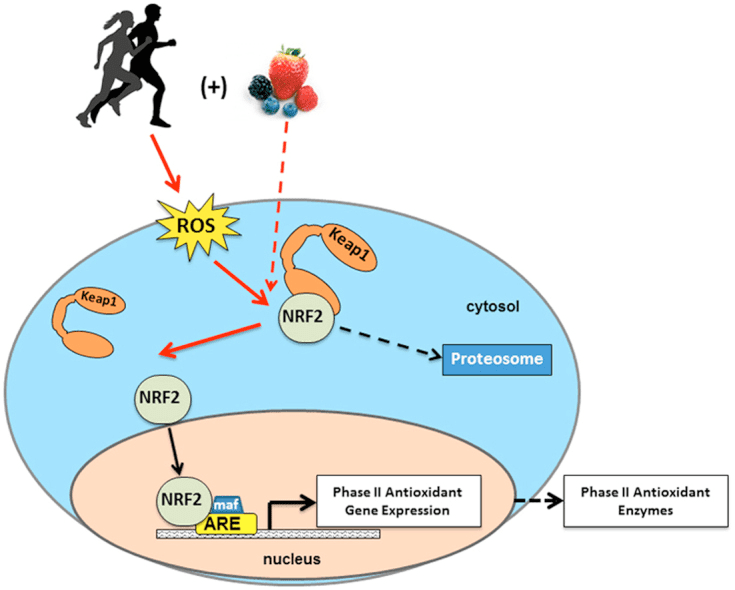
NRF2 是一种线粒体助推器。 NRF2 激活有助于增加线粒体的 ATP 能量,此外还增加了氧、柠檬酸盐和脂肪的使用。 如果没有 NRF2,线粒体只能与糖或葡萄糖一起发挥作用,而不是脂肪。 NRF2 也是线粒体通过称为生物发生的过程发育所必需的。 NRF2 激活对于“利用”运动的好处至关重要。
由于Nrf2的活动,运动会增强线粒体功能,在CoQ10,冬虫夏草和热量限制条件下,这种结果可能会增强。 中等强度的运动或急性运动会诱导线粒体生物发生,并通过NRF1激活引起超氧化物歧化酶或SOD以及血红素加氧酶1或HO-2的合成增加。 α-硫辛酸或ALA和丹参可以促进NRF2介导的线粒体生物发生。 此外,NRF2还可以改善运动耐力,而NRF2的缺失会使运动有害。
防止缺氧
NRF2还有助于保护人体免受细胞氧损失/消耗,这是一种称为缺氧的健康问题。 CIRS患者的NRF2受阻,因此其氧气含量降低,导致VEGF,HIF1和HO-1含量降低。 通常,在缺氧的健康个体中,产生干细胞所需的miR-101过度表达并增加NRF2 / HO-1和VEGF / eNOS的含量,因此可以预防脑损伤,但这种情况似乎并未发生在CIRS中。
由于NRF1失衡,CIRS中以HIF2低为特征的缺氧也可能导致血脑屏障渗漏。 红景天苷位于红景天中,可激活NRF2并通过增加人体内VEGF和HIF1的含量来协助缺氧。 NRF2还可最终防止心脏中乳酸的积累。 NRF2激活也可能会停止低氧引起的高原运动病(AMS)。
延缓衰老
由于通过 NRF2、PPAR-γ 和 FOXO 的异源作用,一些可能大量致命的化合物可能会在相当少量的情况下延长寿命。 极少量的毒素可以提高细胞在下次遇到毒素时更好地装备的能力,但这并不是对消耗有毒化学物质的认可。
这个过程的一个很好的例子是热量限制。 NRF2 可以通过提高细胞的线粒体和抗氧化剂水平以及降低细胞的死亡能力来延长细胞的寿命。 NRF2 会随着年龄的增长而下降,因为 NRF2 可以防止干细胞死亡并帮助它们再生。 NRF2 在促进伤口愈合方面发挥作用。
促进血管系统
如果正确生成萝卜硫烷,NRF2激活可以预防心脏病,例如高血压,高血压,动脉硬化或动脉粥样硬化。 NRF2可以增强乙酰胆碱(或ACh)在血管系统上的松弛活性,同时减少胆固醇引起的压力。 Nrf2激活可能会增强心脏,但是,Nrf2过度激活会增加心血管疾病的可能性。
他汀类药物可能预防或导致心血管疾病。 NRF2在平衡铁和钙方面也起着重要作用,它可以保护人体免受铁含量升高的影响。 例如,Sirtuin 2或SIRT2可以通过激活NRF2来调节细胞中的铁稳态,据信这是健康水平的铁所必需的。 NRF2还可以帮助解决镰状细胞病或SCD。 NRF2功能障碍可能是内毒素血症背后的原因,例如营养不良或凝集素诱发的高血压。 Nrf2还可以保护人体免受苯丙胺引起的血管系统损害。
对抗神经发炎
NRF2可以屏蔽并协助大脑的炎症,通常称为神经炎症。 此外,NRF2可以帮助解决各种中枢神经系统疾病(CNS),包括:
- 阿尔茨海默氏病(AD)–减轻线粒体的淀粉样β应激
- 肌萎缩性侧索硬化症(ALS)
- 亨廷顿舞蹈症(HD)
- 多发性硬化症(MS)的
- 神经再生
- 帕金森氏病(PD)–保护多巴胺
- 脊髓损伤(SCI)
- 中风(缺血性和出血性)–有助于缺氧
- 创伤性脑损伤
NRF2 揭示了患有自闭症谱系障碍或 ASD 的青少年的神经炎症减少。 艾地苯醌与 NRF2 激活剂正确配对,与神经炎症相反。 NRF2 还可以改善血脑屏障,或 BBB。 例如,用从迷迭香和鼠尾草中获得的鼠尾草酸激活 NRF2 可以穿过 BBB 并导致神经发生。 NRF2 也被证明可以提高脑源性神经营养因子,或 BDNF。
NRF2 还可以调节一些营养补充剂产生神经生长因子或 NGF 的能力,因为它还可以通过调节 N-甲基-D-天冬氨酸或 NMDA 受体来帮助解决脑雾和谷氨酸诱导的问题。 它还可以降低喹啉酸(称为 QUIN)的氧化应激。 NRF2 激活可以防止癫痫发作,大剂量可以减少癫痫发作的边缘。 在常规剂量的刺激下,NRF2 可以通过降低大脑中的细胞外谷氨酸以及从谷氨酸和谷胱甘肽中提取半胱氨酸的能力来增强癫痫发作后的认知能力。
缓解抑郁症
在抑郁症中,通常会注意到大脑发炎,尤其是额叶前额叶皮层和海马发炎以及BDNF降低。 在某些类型的抑郁症中,NRF2可以通过降低大脑内的炎症和增加BDNF的水平来改善抑郁症状。 胍丁胺通过提高海马中的去甲肾上腺素,多巴胺,2-羟色胺和BDNF来减轻抑郁的能力取决于NRFXNUMX的激活。
包含抗癌特性
NRF2同样是一种肿瘤抑制因子,因为如果不进行相应的处理,它就是一种肿瘤启动子。 NRF2可以预防由自由基和氧化应激引起的癌症,但是,NRF2的过度表达也可以在癌细胞中发现。 NRF2的强烈激活可以协助多种癌症。 举例来说,补充剂Protandim可以通过激活NRF2来减少皮肤癌。
缓解疼痛
海湾战争疾病(GWI)是一种影响海湾战争退伍军人的显着疾病,是无法解释的慢性症状的集合,可能包括疲劳,头痛,关节痛,消化不良,失眠,头晕,呼吸系统疾病和记忆力问题。 NRF2不仅可以减轻疼痛,还可以通过减少海马和一般炎症来改善GWI症状。 NRF2还可以帮助缓解身体神经损伤引起的疼痛,并改善糖尿病性神经病变引起的神经损伤。
改善糖尿病
高葡萄糖水平,最好被称为高血糖症,由于线粒体功能的破坏而引起细胞的氧化损伤。 NRF2激活可以保护人体免受高血糖对细胞的伤害,从而防止细胞死亡。 NRF2激活还可以保护,恢复和增强胰腺β细胞功能,同时降低胰岛素抵抗。
保护视力和听力
NRF2可以防止糖尿病性视网膜病变对眼睛的伤害。 它也可以避免白内障的形成并保护光感受器,使其免受光诱导的死亡的侵害。 NRF2还可以保护耳朵或耳蜗免受压力和听力损失。
可能帮助肥胖
NRF2可能对肥胖有帮助,主要是因为它具有调节对人体脂肪积累起作用的变量的能力。 萝卜硫烷对NRF2的激活可以提高对脂肪酸合成或FAS和解偶联蛋白或UCP的抑制作用,从而减少脂肪积聚,并增加棕色脂肪的含量,其特征在于包含更多线粒体的脂肪。
保护肠子
NRF2通过保护肠道微生物组稳态来帮助保护肠道。 举例来说,乳酸杆菌益生菌将触发NRF2来保护肠道免受氧化应激。 NRF2还可以帮助预防溃疡性结肠炎或UC。
保护性器官
NRF2 可以保护睾丸并防止糖尿病患者的精子数量受到伤害。 它还可以帮助治疗勃起功能障碍或 ED。 一些增强性欲的补充剂,如黧豆、刺蒺藜和南非醉茄,可能会通过激活 NRF2 来增强性功能。 其他促进 NRF2 的因素,如阳光或西兰花芽,也有助于提高性欲。
调节骨骼和肌肉
氧化应激可能导致骨密度降低和强度降低,这在骨质疏松症中是正常的。 NRF2激活可能具有改善骨骼中抗氧化剂和防止骨骼老化的能力。 NRF2还可以防止肌肉丢失并增强Duchenne肌营养不良症或DMD。
包含抗病毒特性
最后但同样重要的是,NRF2 激活最终可以帮助保护人体免受多种病毒的侵害。 在登革热病毒患者中,与 NRF2 水平较低的个体相比,NRF2 水平较高的个体的症状并不那么强烈。 NRF2 还可以帮助患有人类免疫缺陷 1 病毒或 HIV 的人。 NRF2 可以防止来自腺相关病毒 (AAV) 和幽门螺杆菌的氧化应激。 最后,Lindera Root 可以通过 NRF2 激活来抑制丙型肝炎病毒。
Nrf2或NF-E2相关因子2是在人类中发现的转录因子,它调节特定的一组抗氧化剂和排毒基因的表达。 该信号传导途径由于氧化应激而被激活,因为它增强了许多抗氧化剂和II期肝脏排毒酶,以恢复人体的体内平衡。 人类适应于整个稳态或平衡状态下的功能。 当人体面临氧化应激时,Nrf2会激活以调节氧化并控制其引起的压力。 Nrf2对于预防与氧化应激相关的健康问题至关重要。 CCST Insight的Alex Jimenez博士
萝卜硫素及其对癌症,死亡率,衰老,大脑和行为,心脏病等的影响
异硫氰酸盐是您可以从饮食中获得的一些最重要的植物化合物。 在本视频中,我为他们提供了迄今为止最全面的案例。 注意时间短? 通过单击以下时间点之一,跳到您喜欢的主题。 完整的时间表如下。
关键部分:
- 00:01:14 –癌症与死亡率
- 00:19:04 –老化
- 00:26:30 –大脑与行为
- 00:38:06 –最终回顾
- 00:40:27 –剂量
完整时间表:
- 00:00:34 –视频中的主要焦点萝卜硫烷的介绍。
- 00:01:14 –十字花科蔬菜的食用和全因死亡率的降低。
- 00:02:12 –前列腺癌的风险。
- 00:02:23 –膀胱癌的风险。
- 00:02:34 –吸烟者罹患肺癌的风险。
- 00:02:48 –患乳腺癌的风险。
- 00:03:13 –假设:如果您已经患有癌症该怎么办? (介入式)
- 00:03:35 –驱动癌症和死亡率相关数据的合理机制。
- 00:04:38 –萝卜硫素和癌症。
- 00:05:32 –动物证据显示西兰花芽提取物对大鼠膀胱肿瘤的发展具有很强的作用。
- 00:06:06 –直接补充萝卜硫烷对前列腺癌患者的影响。
- 00:07:09 –实际乳腺组织中异硫氰酸酯代谢物的生物富集。
- 00:08:32 –抑制乳腺癌干细胞。
- 00:08:53 –历史课:芸苔属被认为具有健康特性,即使在古罗马也是如此。
- 00:09:16 –萝卜硫素增强致癌物质(苯,丙烯醛)排泄的能力。
- 00:09:51 – NRF2是通过抗氧化反应元件进行的遗传开关。
- 00:10:10 – NRF2激活如何通过谷胱甘肽-S-结合物增强致癌物排泄。
- 00:10:34 –抱子甘蓝增加了谷胱甘肽-S-转移酶并减少了DNA损伤。
- 00:11:20 –西兰花芽菜饮料使苯的排泄量增加了61%。
- 00:13:31 –西兰花芽苗匀浆可增加上呼吸道的抗氧化酶。
- 00:15:45 –十字花科蔬菜的食用和心脏病的死亡率。
- 00:16:55 –西兰花芽粉可改善2型糖尿病患者的血脂和心脏病风险。
- 00:19:04 –老化部分的开始。
- 00:19:21 –富含萝卜硫素的饮食可将甲虫的寿命从15%延长至30%(在某些条件下)。
- 时间00:20:34 –低炎症对于延年益寿的重要性。
- 时间00:22:05 –十字花科蔬菜和西兰花芽粉似乎可以减少人类的各种炎症标记。
- 00:23:40 –视频中段回顾:癌症,老龄化部分
- 00:24:14 –小鼠研究表明,萝卜硫烷可能会改善老年患者的适应性免疫功能。
- 时间00:25:18 –萝卜硫素改善了秃顶小鼠模型的毛发生长。 图片在00:26:10。
- 00:26:30 –大脑和行为部分的开始。
- 00:27:18 –西兰花芽提取物对自闭症的影响。
- 时间00:27:48 –葡萄糖尿素对精神分裂症的影响。
- 时间00:28:17 –开始讨论抑郁症(可能的机制和研究)。
- 00:31:21 –使用10种不同的压力诱发抑郁模型进行的小鼠研究显示,萝卜硫烷与氟西汀(百忧解)的疗效相似。
- 00:32:00 –研究表明,直接摄入小鼠中的葡甘露聚糖同样可以有效地预防社交失衡应激模型引起的抑郁症。
- 00:33:01 –神经变性部分开始。
- 00:33:30 –萝卜硫素和阿尔茨海默氏病。
- 00:33:44 –萝卜硫素和帕金森氏病。
- 时间00:33:51 –萝卜硫素和亨廷顿氏病。
- 时间00:34:13 –萝卜硫素增加热休克蛋白。
- 时间00:34:43 –脑外伤部分开始。
- 00:35:01 – TBI后立即注射萝卜硫素可改善记忆力(小鼠研究)。
- 00:35:55 –萝卜硫烷和神经元可塑性。
- 00:36:32 –萝卜硫素改善了II型糖尿病小鼠的学习。
- 时间00:37:19 –萝卜硫素和杜氏肌营养不良症。
- 00:37:44 –肌肉卫星细胞中的Myostatin抑制(体外)。
- 00:38:06 –后期录像回顾:死亡率和癌症,DNA损伤,氧化应激和炎症,苯排泄,心血管疾病,II型糖尿病,对大脑的影响(抑郁,自闭症,精神分裂症,神经退行性变),NRF2途径。
- 时间00:40:27 –关于计算出西兰花芽或萝卜硫素剂量的想法。
- 00:41:01 –在家发芽的轶事。
- 00:43:14 –关于烹饪温度和萝卜硫素活性。
- 时间00:43:45 –肠道细菌从葡糖萝卜素转化为萝卜硫素。
- 时间00:44:24 –补充剂与蔬菜中的活性黑芥子酶结合使用时效果更好。
- 时间00:44:56 –烹饪技巧和十字花科蔬菜。
- 00:46:06 –异硫氰酸酯作为甲状腺激素。
当人体面临有害的内部和外部因素(如毒素)时,细胞必须迅速触发其抗氧化能力以抵抗氧化应激。 由于已经确定增加的氧化应激水平会导致多种健康问题,因此使用Nrf2激活来利用其优势非常重要。 我们的信息范围仅限于脊椎治疗和脊柱健康问题。 要讨论主题,请随时询问Jimenez博士或通过以下方式与我们联系。915-850-0900 。
由Alex Jimenez博士策划
附加主题讨论:急性腰痛
背疼�是全球范围内最常见的残疾和误工原因之一。 背痛是就诊的第二大常见原因,仅次于上呼吸道感染。 大约 80% 的人一生中至少会经历一次背痛。 脊柱是由骨骼、关节、韧带和肌肉以及其他软组织组成的复杂结构。 因此,受伤和/或病情加重,例如。椎间盘突出,最终会导致背部疼痛的症状。 运动伤害或汽车事故伤害通常是造成背痛的最常见原因,但是,有时最简单的动作可能会产生痛苦的结果。 幸运的是,诸如脊椎治疗等替代疗法可以通过使用脊柱调节和手动操作来帮助缓解背部疼痛,最终改善疼痛缓解。
***

by 亚历克斯·希门尼斯博士 | 慢性疼痛, 排毒, 饮食, 功能医学, 健康管理, 整体医学, 自然健康, 营养学, 氧化应激, 补救措施, 研究研究, 补充品, 疗程, 健康
萝卜硫素 是一种植物化学物质,属于有机硫化合物的异硫氰酸酯基团中的一种物质,存在于十字花科蔬菜中,例如西兰花、卷心菜、花椰菜和球芽甘蓝。 它也可以在白菜、羽衣甘蓝、羽衣甘蓝、芥菜和豆瓣菜中找到。 研究表明,萝卜硫素可以通过以下方式帮助预防各种类型的癌症 激活 Nrf2 的产生或核因子红细胞 2 相关因子,一种转录因子,可调节保护性抗氧化机制,控制细胞对氧化剂的反应。 以下文章的目的是描述萝卜硫素的功能。
抽象
KEAP1-Nrf2-ARE 抗氧化系统是细胞对氧化和外源性应激作出反应的主要手段。 萝卜硫素 (SFN) 是一种源自十字花科蔬菜的亲电子异硫氰酸酯,可激活 KEAP1-Nrf2-ARE 通路,并已成为治疗慢性氧化应激起主要病因学作用的疾病的一个重要分子。 我们在这里证明,用 SFN 处理的培养的人视网膜色素上皮 (RPE-1) 细胞的线粒体经历了不依赖于 Nrf2 及其细胞质抑制剂 KEAP1 的超融合。 据报道,线粒体融合通过抑制细胞凋亡过程中线粒体中的孔形成而具有细胞保护作用,并且与此一致,我们展示了暴露于凋亡诱导剂星形孢菌素的 SFN 处理的细胞的 Nrf2 非依赖性细胞保护作用。 从机制上讲,SFN 减轻了可溶性裂变因子 Drp1 向线粒体和过氧化物酶体的募集和/或保留,但不影响 Drp1 的总体丰度。 这些数据表明,SFN 的有益特性超出了 KEAP1-Nrf2-ARE 系统的激活范围,鉴于目前该药物在多项临床试验中的使用,值得进一步研究。
关键词: 萝卜硫素、Nrf2、Drp1、线粒体、裂变、融合、细胞凋亡
介绍
萝卜硫素是一种不依赖 Nrf2 的线粒体裂变抑制剂
萝卜硫素 (SFN) 是一种异硫氰酸酯化合物,来源于饮食中最常见的十字花科蔬菜 [56]。 它是在植物中产生的,作为对捕食的外源性反应,通过受损细胞中水解酶黑芥子酶的囊泡释放; 这种酶将硫代葡萄糖苷转化为异硫氰酸盐[42]。 在过去的二十年里,SFN 因其报道的抗癌、抗氧化和抗菌特性而被广泛描述 [57]。 这种功效大部分归因于 SFN 调节 KEAP1-Nrf2-抗氧化反应元件 (ARE) 信号通路的能力,尽管已经确定了该化合物的其他活性,包括抑制组蛋白脱乙酰酶活性和细胞周期进程。 29]。 Nrf2 是主要的抗氧化转录因子,在稳态条件下,其稳定性通过细胞质 Cullin3KEAP1 泛素连接酶复合物的作用受到抑制 [20]。 具体而言,Nrf2 通过与二聚体底物接头 KEAP3 结合而被招募到 Cullin1KEAP1 连接酶,随后用针对蛋白酶体介导的降解的转录因子的 polyUb 链进行修饰。 这种本构转换将 Nrf2 在非应激细胞中的半衰期限制在约 15 分钟 [30]、[33]、[46]、[55]。 为了应对多种类型的压力,尤其是氧化应激,富含半胱氨酸的蛋白质 KEAP1 充当氧化还原传感器,KEAP151 的关键半胱氨酸,特别是 C1 的氧化修饰将 Nrf2-KEAP1 从 CUL3 解离,从而防止 Nrf2 降解。 8]、[20]、[55]。 值得注意的是,SFN 和可能的其他 Nrf2 激活剂通过修饰 KEAP151 的 C1 来模拟氧化应激,例如 [21]。 Nrf2 的稳定化使其易位到细胞核,在那里它诱导一组 II 期抗氧化和解毒基因的表达。 Nrf2 通过与小 Maf 蛋白的异二聚化与其同源靶基因的抗氧化反应启动子元件 (ARE) 结合 [19]。 该系统对 SFN 等间接抗氧化剂、线粒体产生的自由基 [16] 或其他氧化应激的生理来源 [41] 呈现动态和敏感的反应。
线粒体是动态的亚细胞细胞器,可调节从 ATP 产生和细胞内钙缓冲到氧化还原调节和细胞凋亡的一系列细胞功能 [13]、[49]。 线粒体也代表细胞内活性氧 (ROS) 的主要来源。 因此,线粒体功能的适当调节对于优化 ATP 产生以满足细胞需求,同时最大限度地减少过度自由基产生的潜在有害影响是必要的。 线粒体功能精细调节的一个关键要求是线粒体既能作为生化机器独立发挥作用,又能作为庞大响应网络的一部分发挥作用的能力。
线粒体网络形态和功能由裂变和融合之间的调节平衡决定。 线粒体分裂是细胞分裂过程中线粒体的子细胞遗传所必需的 [28] 以及去极化或受损线粒体的选择性自噬降解,称为线粒体自噬 [1]。 相反,线粒体基因组的互补和相邻线粒体之间电子传递链组件的共享需要融合[54]。 在分子水平上,线粒体裂变和融合受到大的、类似动力蛋白的 GTP 酶的调节。 三种酶主要调节融合:Mitofusins 1 和 2 (Mfn1/2) 是两通外膜蛋白,通过相邻线粒体之间的异型相互作用介导外膜融合 [15]、[25]、[37],而 OPA1 是内膜蛋白膜蛋白,通过调节内膜的融合同时确保基质连接性 [5]。 所有三种蛋白质的 GTPase 活性是稳健融合所必需的 [5]、[18],并且 OPA1 进一步受到蛋白酶 OMA1 [14]、PARL [6] 和 YME1L [45] 线粒体内膜内复杂蛋白水解的调节]。 重要的是,为了抑制受损和健康线粒体的整合,有效融合需要完整的线粒体膜电位 [26]。
线粒体裂变主要由称为动力相关蛋白 1 (Drp1/DNM1L) 的胞质蛋白催化。 Drp1 从胞质溶胶中募集到线粒体外膜上的预期裂变位点 [43]。 外膜上 Drp1 的主要受体是线粒体裂变因子 (Mff) [32],其次是裂变 1 (Fis1) [51]。 此外,还发现了一种诱饵受体 MIEF1/MiD51,它可以进一步限制 Drp1 蛋白在潜在裂变位点的活性 [58]。 一旦停靠在线粒体外膜上,Drp1 就会在线粒体体周围寡聚成螺旋状结构,然后利用 GTP 水解产生的能量来介导线粒体外膜和内膜的物理断裂 [17]。 内质网衍生的小管在 Drp1 寡聚化之前充当线粒体的初始收缩器,强调了非收缩线粒体比完整的 Drp1 螺旋的允许周长更宽的启示[12]。 肌动蛋白动力学对于线粒体裂变之前的 ER-线粒体相互作用也很重要 [24]。 除了在线粒体裂变中的作用外,Drp1 还催化过氧化物酶体的裂变 [40]。
Drp1 与充分表征的动力蛋白非常相似,因为这两种蛋白质都包含一个 N 端 GTPase 结构域、一个对自寡聚化至关重要的中间结构域和一个 C 端 GTPase 效应结构域 [31]。 Drp1 通过与其受体蛋白 Mff 和 Fis1 相互作用的组合以及通过 Drp1 独特的 B 插入结构域对线粒体特异性磷脂心磷脂的亲和力来实现对线粒体膜的选择性[2]。 Drp1 通常作为同型四聚体存在于细胞质中,线粒体裂变位点的高阶组装由 Drp1 的中间结构域介导 [3]。
鉴于线粒体功能与 KEAP1-Nrf2-ARE 通路之间的隐含联系,我们研究了 Nrf2 激活对线粒体结构和功能的影响。 我们在这里证明 SFN 诱导线粒体过度融合,出乎意料的是,它独立于 Nrf2 和 KEAP1。 SFN 的这种作用是通过抑制 Drp1 功能。 我们进一步证明 SFN 赋予了对 Nrf2 独立的细胞凋亡的抗性,并模拟了在耗尽 Drp1 的细胞中观察到的抗性。 这些数据共同表明,除了稳定和激活 Nrf2 外,SFN 还调节线粒体动力学并保持细胞适应性和存活。
成果
萝卜硫素诱导 Nrf2/KEAP1 非依赖性线粒体过度融合
在研究 Nrf2 激活对线粒体网络动力学的影响的过程中,我们发现用 Nrf1 信号传导的强效激活剂萝卜硫素 (SFN) 处理永生化的人视网膜色素上皮 (RPE-2) 细胞,诱导了与载体处理的对照细胞相比,线粒体网络(图 1A 和 B)。 这些细胞中线粒体的形态与内源性 Drp1(主要的线粒体裂变因子)的 siRNA 耗尽的细胞中的线粒体形态非常相似(图 1A)。 这一结果提出了一个有趣的想法,即线粒体裂变和融合状态直接响应细胞中的 Nrf2 水平。 然而,用其他 Nrf2 稳定剂和激活剂如蛋白酶体抑制剂 MG132、促氧化剂 tBHQ 或 Nrf2 抑制剂 KEAP1 的敲低刺激细胞不会诱导线粒体融合(图 1A 和 B)。 通过内源性 Nrf2 的蛋白质印迹证实了这些操作对 Nrf2 的稳定性(图 1C)。 此外,Nrf2 的表达对于 SFN 诱导的线粒体融合是可有可无的,因为用 siRNA 敲低内源性 Nrf2 未能对抗这种表型(图 1D-F)。 因为 SFN 通过共价修饰 KEAP1 的半胱氨酸残基 [2] 来刺激 KEAP1-Nrf21-ARE 通路,我们敲低了 KEAP1 以解决 SFN 诱导的线粒体过度融合是否通过 KEAP1 依赖但 Nrf2 独立的通路受到刺激。 然而,KEAP1 的消耗也未能消除 SFN 诱导的线粒体融合(图 1G-I)。 事实上,SFN 逆转了由 KEAP1 耗尽引起的前裂变形态(图 1G,图 b 与图 d)。 这些结果表明,SFN 治疗导致线粒体融合独立于经典的 KEAP1-Nrf2-ARE 途径,并导致我们询问 SFN 是否直接影响线粒体裂变或融合机制的成分。
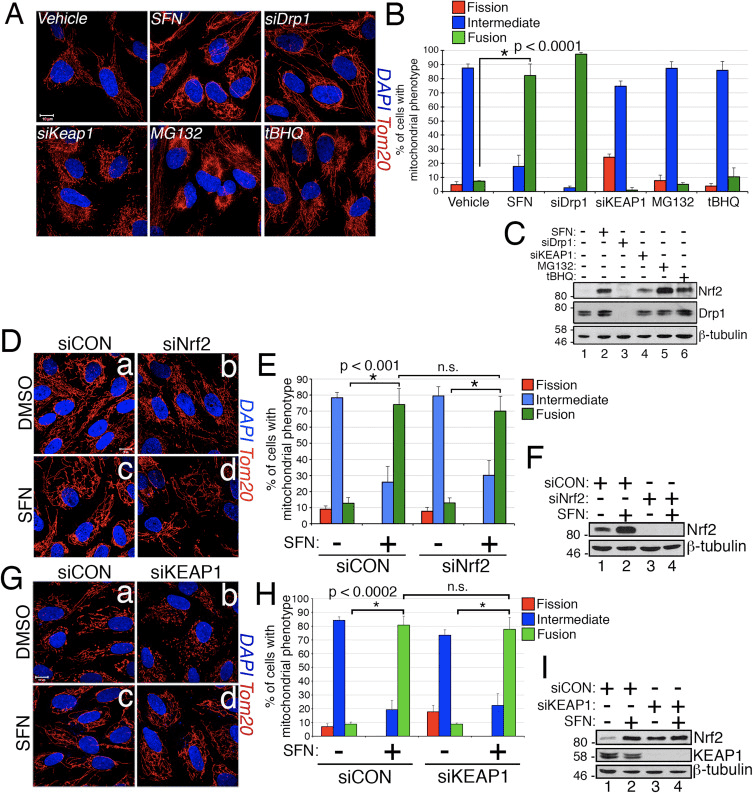 图 1 SFN 诱导 Nrf2/KEAP1 非依赖性线粒体融合。 (A) 用指定的 siRNA 转染 RPE-1 细胞,3 天后用 DMSO 或 Nrf2 激活剂 SFN (50 µM)、MG132 (10 µM) 或 tBHQ (100 µM) 处理 4 小时。 线粒体(红色)用抗 Tom20 抗体标记,细胞核(蓝色)用 DAPI 复染。 (B) 显示 (A) 中线粒体形态评分量化的图表。 以盲法评估每种条件 > 50 个细胞。 (C) 来自 (A) 的代表性蛋白质印迹。 (D) 用 1 nM siRNA 转染 RPE-10 细胞,3 天后用 SFN 处理 4 小时,然后如 (A) 所示进行固定和染色。 (E) 显示 (D) 中线粒体表型评分量化的图表。 以盲法评估每种条件 > 100 个细胞。 (F) 来自 (D) 的代表性蛋白质印迹。 (G) 用 siCON 或 siKEAP1 转染和处理 (D) 细胞。 (H) 根据线粒体形态对 (G) 中的细胞进行评分 (B) 和 (E)。 (I) 来自 (G) 的代表性蛋白质印迹。 (B)、(E) 和 (H) 中的数据分别由 3 个独立实验汇编而成,统计显着性由双尾学生 t 检验确定。 误差线反映 +/- SD(为了解释此图例中对颜色的引用,读者可参考本文的网络版本)。
图 1 SFN 诱导 Nrf2/KEAP1 非依赖性线粒体融合。 (A) 用指定的 siRNA 转染 RPE-1 细胞,3 天后用 DMSO 或 Nrf2 激活剂 SFN (50 µM)、MG132 (10 µM) 或 tBHQ (100 µM) 处理 4 小时。 线粒体(红色)用抗 Tom20 抗体标记,细胞核(蓝色)用 DAPI 复染。 (B) 显示 (A) 中线粒体形态评分量化的图表。 以盲法评估每种条件 > 50 个细胞。 (C) 来自 (A) 的代表性蛋白质印迹。 (D) 用 1 nM siRNA 转染 RPE-10 细胞,3 天后用 SFN 处理 4 小时,然后如 (A) 所示进行固定和染色。 (E) 显示 (D) 中线粒体表型评分量化的图表。 以盲法评估每种条件 > 100 个细胞。 (F) 来自 (D) 的代表性蛋白质印迹。 (G) 用 siCON 或 siKEAP1 转染和处理 (D) 细胞。 (H) 根据线粒体形态对 (G) 中的细胞进行评分 (B) 和 (E)。 (I) 来自 (G) 的代表性蛋白质印迹。 (B)、(E) 和 (H) 中的数据分别由 3 个独立实验汇编而成,统计显着性由双尾学生 t 检验确定。 误差线反映 +/- SD(为了解释此图例中对颜色的引用,读者可参考本文的网络版本)。
萝卜硫素损害 Drp1 的线粒体协会
基于 SFN 处理诱导线粒体过度融合的发现,我们推断这种表型是过度融合活性或分裂活性抑制的结果。 为了区分这两种可能性,我们比较了存在和不存在 SFN 时过氧化物酶体的形态。 过氧化物酶体与线粒体相似,因为它们是动态细胞器,其形状和长度不断变化[44]。 过氧化物酶体在其外膜中同时包含 Fis1 和 Mff,因此,它们是 Drp1 介导的裂变的目标 [22]、[23]。 然而,过氧化物酶体不利用线粒体网络的融合机制,因此不进行融合 [39]。 相反,过氧化物酶体裂变与通过从头添加膜和蛋白质来延长现有过氧化物酶体相反[44]。 因为过氧化物酶体缺乏 Mfn1/2 和 OPA1,我们推断如果 SFN 激活融合机制而不是抑制裂变机制,过氧化物酶体长度不会受到影响。 在载体处理的细胞中,过氧化物酶体保持为短而圆的点状细胞器(图 2,图 b 和 d)。 然而,与对照细胞相比,SFN 处理使过氧化物酶体长度增加了约 2 倍(图 2,小图 f 和 h)。 此外,许多过氧化物酶体被夹在中心附近,表明存在潜在的断裂缺陷(图 2,小图 h,箭头)。 同样,用 Drp1 siRNA 转染的细胞中的过氧化物酶体异常长(图 2,图 j 和 l),证实 Drp1 是过氧化物酶体裂变所必需的,并表明 SFN 处理通过破坏裂变机制导致线粒体和过氧化物酶体表型。
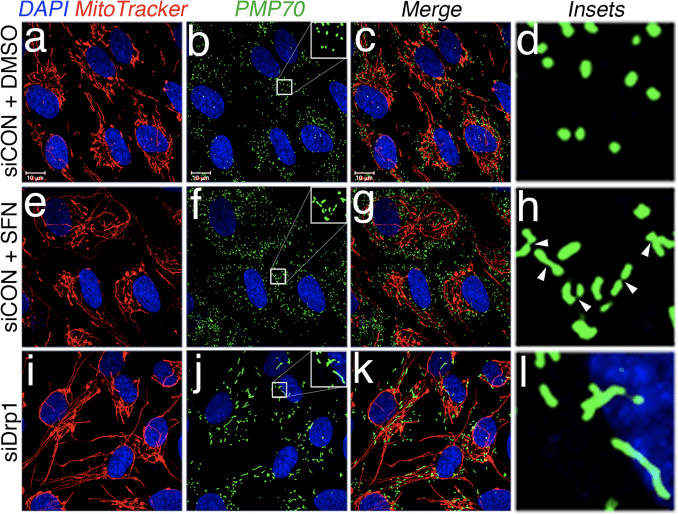 图 2 SFN 诱导过氧化物酶体延长。 (A) 用 1 nM 所示 siRNA 转染 RPE-10 细胞,3 天后用 DMSO 或 50 μM SFN 处理 4 小时。 过氧化物酶体(绿色)用抗 PMP70 抗体标记,线粒体用 MitoTracker(红色)标记,DNA 用 DAPI 复染。 右侧显示了放大的过氧化物酶体插图(图 d、h 和 l),以促进 SFN 和 Drp1 消耗引起的形态变化的可视化。 箭头突出显示收缩点。 (有关此图例中颜色参考的解释,请读者参考本文的网络版本)。
图 2 SFN 诱导过氧化物酶体延长。 (A) 用 1 nM 所示 siRNA 转染 RPE-10 细胞,3 天后用 DMSO 或 50 μM SFN 处理 4 小时。 过氧化物酶体(绿色)用抗 PMP70 抗体标记,线粒体用 MitoTracker(红色)标记,DNA 用 DAPI 复染。 右侧显示了放大的过氧化物酶体插图(图 d、h 和 l),以促进 SFN 和 Drp1 消耗引起的形态变化的可视化。 箭头突出显示收缩点。 (有关此图例中颜色参考的解释,请读者参考本文的网络版本)。
我们接下来确定了 SFN 如何限制 Drp1 功能。 可能性包括表达水平的降低、线粒体的募集/保留、寡聚化或 GTPase 的酶活性。 其中任何一项的缺陷都会导致线粒体裂变和过度融合减少。 我们没有检测到 SFN 处理后 Drp1 蛋白水平的可重复变化(图 1C 和 3A),因此得出结论,SFN 不会改变 Drp1 的稳定性或表达,这与半衰期大于 1 小时的 Drp10 一致[50]我们的 SFN 治疗持续时间较短。 接下来,我们研究了 SFN 是否影响 Drp1 向线粒体的募集或保留。 分级研究表明,SFN 诱导线粒体级分中 Drp1 的损失(图 3A,泳道 7-8 和图 3B)。 如先前报道的[43],在稳态条件下的任何给定时间,只有一小部分 Drp1(~3%)与线粒体网络相关,大部分酶存在于细胞质中(图 3A,泳道 5-8 )。 使用共定位分析证实了这些分级数据,该分析显示在 SFN 处理后线粒体定位的点状 Drp40 病灶减少了约 1%(图 3C 和 D)。 总之,这些数据表明,SFN 诱导的线粒体融合至少部分是由于 Drp1 与线粒体的减弱关联。 我们的数据没有区分 SFN 是否干扰线粒体募集与 Drp1 的线粒体保留,或两者兼而有之,因为内源性 Drp1 的分析不适合通过活细胞显微镜观察 GTPase。
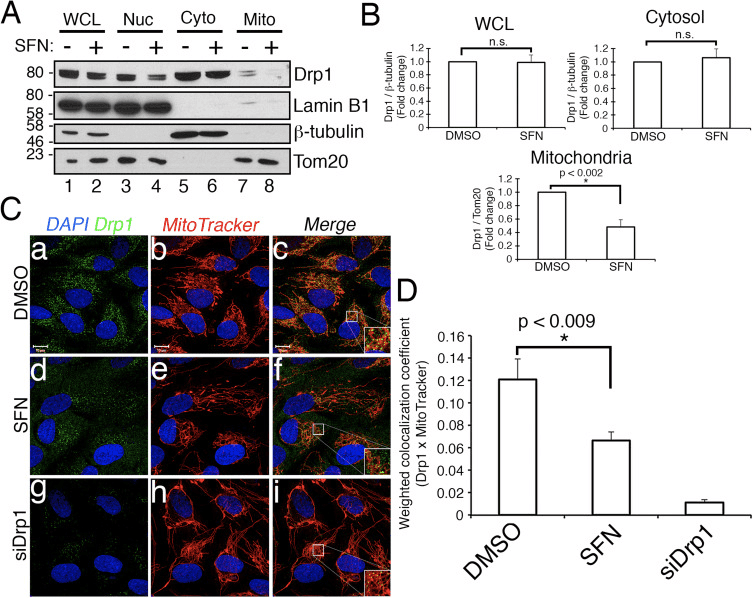 图 3 SFN 导致线粒体中 Drp1 的丢失。 (A) DMSO 或 SFN 1 小时后 RPE-4 细胞的亚细胞分离。 全细胞裂解物 (WCL)、细胞核 (Nuc)、细胞溶质 (Cyto) 和粗线粒体 (Mito) 部分通过 SDS-PAGE 分离,并用指定的抗体进行蛋白质印迹处理。 分子量标记的迁移显示在左侧。 (B) 图表显示了 (A) 中所示分数中 Drp1 的光密度定量。 (C) RPE-1 细胞用 10 nM siCON 或 siDrp1 转染,3 天后用 DMSO 或 SFN 处理 4 小时。 Drp1(绿色)用抗 Drp1 抗体可视化,线粒体用 MitoTracker(红色)和细胞核用 DAPI(蓝色)。 (D) 来自 (C) 的 Drp1 和 MitoTracker 信号的自动共定位分析。 (B) 和 (D) 中的数据分别来自 3 个和 5 个独立实验,统计显着性由双尾学生 t 检验确定。 误差线反映 +/- SD,星号表示统计显着性。 (有关此图例中颜色参考的解释,请读者参考本文的网络版本)。
图 3 SFN 导致线粒体中 Drp1 的丢失。 (A) DMSO 或 SFN 1 小时后 RPE-4 细胞的亚细胞分离。 全细胞裂解物 (WCL)、细胞核 (Nuc)、细胞溶质 (Cyto) 和粗线粒体 (Mito) 部分通过 SDS-PAGE 分离,并用指定的抗体进行蛋白质印迹处理。 分子量标记的迁移显示在左侧。 (B) 图表显示了 (A) 中所示分数中 Drp1 的光密度定量。 (C) RPE-1 细胞用 10 nM siCON 或 siDrp1 转染,3 天后用 DMSO 或 SFN 处理 4 小时。 Drp1(绿色)用抗 Drp1 抗体可视化,线粒体用 MitoTracker(红色)和细胞核用 DAPI(蓝色)。 (D) 来自 (C) 的 Drp1 和 MitoTracker 信号的自动共定位分析。 (B) 和 (D) 中的数据分别来自 3 个和 5 个独立实验,统计显着性由双尾学生 t 检验确定。 误差线反映 +/- SD,星号表示统计显着性。 (有关此图例中颜色参考的解释,请读者参考本文的网络版本)。
萝卜硫素可保护不受 Nrf2 影响的 Staurosportine 诱导的细胞凋亡
先前的研究表明,线粒体裂变允许在细胞凋亡过程中由 Bax/Bak 产生的线粒体外膜孔形成 [11]。 Drp1 已被证明在细胞凋亡过程中被选择性地募集到线粒体 [11],并且与此一致,在该过程的早期已经观察到片段化的线粒体 [27]。 相反,抑制线粒体分裂被认为通过阻止允许细胞色素 c 释放的外膜孔的形成来抑制细胞凋亡 [53]。 因此,刺激线粒体融合可延缓由包括星形孢菌素 (STS) 在内的化合物诱导的细胞凋亡进程 [14]。 为了确定 SFN 是否保护 RPE-1 细胞免受 STS 介导的细胞凋亡,如果是,这是否需要 Nrf2,我们建立了一种易于诱导多聚 ADP 核糖聚合酶 (PARP) 切割的测定法,这是活化 caspase-3 的底物和确定的标志物。细胞凋亡。 用 1 μM STS 处理 RPE-1 细胞 6 小时仅引起非常适度的 PARP 裂解,但这被 SFN 共同处理所阻止(例如,图 4A,泳道 3 对 4)。 为了提高该测定的稳健性,我们通过用靶向抗凋亡因子 Bcl-XL 的 siRNA 预处理细胞,进一步使细胞对 STS 诱导的细胞凋亡敏感。 这种预处理降低了 Bcl-XL 的表达,并显着促进了 PARP 裂解,作为暴露于 STS 的时间的函数(图 4B,比较泳道 2 和泳道 4-10)。 重要的是,用 SFN 预处理 2 小时减轻了暴露于 STS 的细胞中的 PARP 裂解(图 4C,泳道 3 对 4 和泳道 5 对 6)。 同样,通过 CRISPR/Cas2 稳定耗尽 Nrf9 的细胞通过 SFN 预处理得到了类似的保护,免受 STS 毒性的影响(图 4C,泳道 11 对 12,泳道 13 对 14 和图 4D)。 使用 PARP 裂解(图 4C 和 D)和细胞形态(图 4E)作为读数观察到这种保护。 通过蛋白质印迹证实了 CRISPR/Cas2 去除 Nrf9 的功效(图 4C,Nrf2 印迹)。 正如预测的那样,与用 SFN 孵育的对照细胞相比,Drp1 的消耗细胞也产生超融合表型(图 1A),也阻断了响应于 STS 的 PARP 切割(图 4F 和 G)。 总之,这些发现与 SFN 通过其限制 Drp1 功能的能力赋予细胞凋亡保护作用是一致的,与 Nrf2 的稳定和激活无关。
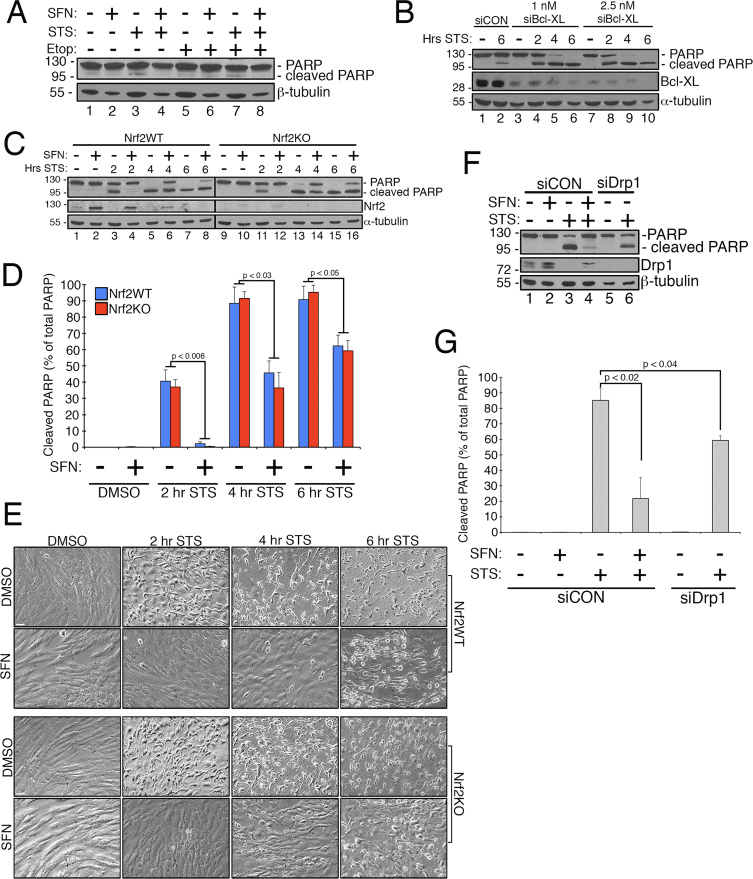 图 4 SFN 的细胞保护作用与 Nrf2 表达无关 (A) RPE-1 细胞用 DMSO 或 50 μM SFN 预处理 2 小时,然后用 DMSO、1 μM 星形孢菌素 (STS) 或 50 μM 处理Metoposide 6 小时并进行抗 PARP 蛋白质印迹处理。 (B) 用 1 nM siCON、2.5 nM siBcl-XL 或 1 nM siBcl-XL 转染 RPE-2.5 细胞,3 天后用 DMSO 或 1 μM STS 处理 2、4 或 6 小时。 显示了代表性的蛋白质印迹,左侧显示了分子量标记的迁移。 (C) 用 9 nM siBcl-XL 转染 CRISPR/Cas2 生成的野生型 (Nrf2WT) 和 Nrf2 敲除 (Nrf1KO) RPE-1 细胞,3 天后用 DMSO 或 50 μM SFN 预处理 2 小时. 随后,用 1 μM STS 处理细胞 2、4 或 6 小时。 显示了具有指定抗体的代表性蛋白质印迹。 (D) 从 3 个独立实验中将切割的 PARP 量化为总 PARP(切割 + 未切割)的百分比。 重要的是,无论细胞是否表达 Nrf2,切割的 PARP 水平是相当的,这表明对 STS 的 SFN 保护与转录因子无关。 (E) 在从 (C) 中收获裂解物之前立即拍摄的 20X 相位对比图像。 比例尺 = 65 微米。 (F) 具有代表性的蛋白质印迹表明 Drp1 的消耗与 SFN 治疗相比,对 STS 的保护几乎可比。 RPE-1 细胞用 1 nM siBcl-XL 转染,另外用 10 nM siCON 或 10 nM siDrp1 转染。 3 天后,如 (A) 和 (C) 所示,用 SFN 预处理 siCON 细胞,然后在收获前暴露于 STS 4 小时,并用指定的抗体进行蛋白质印迹处理。 (G) 与 (D) 中 (F) 中提供的数据相同,该数据由 3 个独立实验汇编而成。 误差线反映 +/- SEM
图 4 SFN 的细胞保护作用与 Nrf2 表达无关 (A) RPE-1 细胞用 DMSO 或 50 μM SFN 预处理 2 小时,然后用 DMSO、1 μM 星形孢菌素 (STS) 或 50 μM 处理Metoposide 6 小时并进行抗 PARP 蛋白质印迹处理。 (B) 用 1 nM siCON、2.5 nM siBcl-XL 或 1 nM siBcl-XL 转染 RPE-2.5 细胞,3 天后用 DMSO 或 1 μM STS 处理 2、4 或 6 小时。 显示了代表性的蛋白质印迹,左侧显示了分子量标记的迁移。 (C) 用 9 nM siBcl-XL 转染 CRISPR/Cas2 生成的野生型 (Nrf2WT) 和 Nrf2 敲除 (Nrf1KO) RPE-1 细胞,3 天后用 DMSO 或 50 μM SFN 预处理 2 小时. 随后,用 1 μM STS 处理细胞 2、4 或 6 小时。 显示了具有指定抗体的代表性蛋白质印迹。 (D) 从 3 个独立实验中将切割的 PARP 量化为总 PARP(切割 + 未切割)的百分比。 重要的是,无论细胞是否表达 Nrf2,切割的 PARP 水平是相当的,这表明对 STS 的 SFN 保护与转录因子无关。 (E) 在从 (C) 中收获裂解物之前立即拍摄的 20X 相位对比图像。 比例尺 = 65 微米。 (F) 具有代表性的蛋白质印迹表明 Drp1 的消耗与 SFN 治疗相比,对 STS 的保护几乎可比。 RPE-1 细胞用 1 nM siBcl-XL 转染,另外用 10 nM siCON 或 10 nM siDrp1 转染。 3 天后,如 (A) 和 (C) 所示,用 SFN 预处理 siCON 细胞,然后在收获前暴露于 STS 4 小时,并用指定的抗体进行蛋白质印迹处理。 (G) 与 (D) 中 (F) 中提供的数据相同,该数据由 3 个独立实验汇编而成。 误差线反映 +/- SEM
讨论
我们发现 SFN 调节线粒体裂变/融合动力学,与其对 KEAP1-Nrf2-ARE 通路的影响无关。 这很有趣,因为假设线粒体功能障碍和 ROS 产生之间存在联系,并且有必要通过激活 Nrf2 来抑制线粒体衍生的自由基。 鉴于目前正在进行的 30 多项临床试验正在测试 SFN 治疗包括前列腺癌、阻塞性肺病和镰状细胞病在内的多种疾病,SFN 的这种额外功能影响具有潜在的重要性 [7]、[10]、[ 47]。
因为 SFN 是一种异硫氰酸酯 [56],它通过直接酰化关键的 KEAP2 半胱氨酸来抑制 Nrf1 降解来激活 Nrf2 信号传导 [21],因此 SFN 通过半胱氨酸修饰调节裂变或融合因子的活性来发挥其促融合作用. 我们的数据强烈支持 Drp1 受到 SFN 的负调控,尽管 GTPase 是否是酰化的直接目标仍有待阐明。 尽管存在这种知识差距,但 Drp1 的功能显然受到 SFN 的影响,因为线粒体和过氧化物酶体都响应 SFN 治疗而变得过度融合,并且这些细胞器在各自的断裂事件中共享 Drp1 [38]。 此外,SFN 减少了在线粒体中定位和积累的 Drp1 的数量(图 XNUMX)。 3)。 因为我们的实验是用所有内源性蛋白质完成的,我们在线粒体裂变位点对 Drp1 的检测处于稳态条件下,因此,我们无法区分由 SFN 引起的酶的募集和保留缺陷。 此外,我们还不能消除 SFN 酰化线粒体受体(Fis1 或 Mff)以阻止 Drp1 募集的可能性,我们怀疑 Drp1 被直接修饰。 Drp1 有九个半胱氨酸,其中八个位于寡聚化所需的中间结构域 [3],其中一个位于 Drp1 C 末端的 GTP 酶效应结构域 (GED)。 任何这些半胱氨酸的直接酰化都可能导致 Drp1 的活性缺陷,因此是 SFN 对线粒体动力学影响的基础。 值得注意的是,先前的研究表明,寡聚化和催化活性的缺陷可以消除 Drp1 在线粒体中的保留 [52]。 GED 结构域中的 Cys644 是一个特别有吸引力的目标,基于以前的工作表明这种半胱氨酸的突变会导致损害 Drp1 GTPase 活性的突变 [4],并且这种特殊的半胱氨酸被硫醇反应性亲电试剂修饰 [9]。 这个悬而未决的问题的解决将需要质谱验证。总之,我们已经为临床相关的化合物 SFN 确定了一种新颖的细胞保护功能。 除了激活主要的抗氧化转录因子 Nrf2 外,SFN 还促进线粒体和过氧化物酶体的融合,这种作用与 Nrf2 无关。 这种现象背后的机制涉及 GTPase Drp1 功能的降低,GTPase DrpXNUMX 是线粒体和过氧化物酶体裂变的主要介质。 SFN 介导的线粒体融合的主要后果是细胞对凋亡诱导剂星形孢菌素的毒性作用产生抗性。 SFN 的这种额外的细胞保护作用可能在许多以年龄为主要危险因素的神经退行性疾病(例如,帕金森病、阿尔茨海默病、年龄相关性黄斑变性)中具有特殊的临床效用,因为这些疾病与细胞凋亡有关并减少Nrf2 [35]、[36]、[48] 的水平和/或失调。
材料和方法
细胞凋亡检测
如下所示,用siRNA接种细胞并转染细胞。 细胞用 50 ?M 萝卜硫素预处理 2 小时以诱导线粒体融合,然后用 1 ?M 星形孢菌素处理以诱导细胞凋亡。 在收获时,将培养基收集在单独的试管中并进行高速离心以沉淀凋亡细胞。 将该细胞沉淀与贴壁细胞混合并溶解在 2 倍浓缩的 Laemmli 缓冲液中。 对样品进行抗 PARP 蛋白质印迹。
CRISPR/Cas9 构建体生成
为了创建 LentiCRISPR/eCas9 1.1,首先使用 Age2 和 BamH52961 切割 LentiCRISPR v1 (addgene #1)。 接下来,使用以下引物(正向 AGCGCACCGGTTCTAGAGCGCTGCCACCATGGACTATAAGGACCACGAC、反向 AAGCGCGGATCCCTTTTTCTTTTTTGCCTGGCCGG)对来自 eSpCas9 9(addgene #1.1)的 SpCas71814 进行 PCR 扩增,并连接到上面的切割载体中。 通过使用 Benchling.com 确定 sgRNA 序列。 设置参数以靶向具有最高在靶和最低脱靶分数的编码序列。 下列序列(靶向序列加下划线,HS sgNFE1L1#2感CACCGCGACGGAAAGAGTATGAGC,反义AAACGCTCATACTCTTTCCGTCGC; HS sgNFE2L1#2感CACCGGTTTCTGACTGGATGTGCT,反义AAACAGCACATCCAGTCAGAAACC; HS sgNFE2L2#2感CACCGGAGTAGTTGGCAGATCCAC,反义AAACGTGGATCTGCCAACTACTCC)退火并连接到BsmB2切割LentiCRISPR / eCas3 1。 用嘌呤霉素选择慢病毒感染的 RPE-9 细胞并保持为一个混合群体。 通过免疫荧光和蛋白质印迹确认敲除。
细胞培养和转染
用端粒酶 (RPE-1) (ATCC) 转化的人视网膜色素上皮细胞在含有 1 g/L 葡萄糖并补充有青霉素、链霉素、1X 非必需氨基酸混合物 (Life Technologies) 的 Dulbecco 改良 Eagle 培养基 (DMEM) 中培养,和 10% 胎牛血清(Life Technologies)。 对于 siRNA 转染,在一夜之间接种 30,000-35,000 个细胞/mL。 细胞接受在无血清 DMEM 中稀释的 10 nM siRNA 并与 0.3% 干扰素转染试剂 (PolyPlus) 结合。 对于细胞凋亡敏化,细胞接受 1 nM Bcl-XL siRNA。 转染后 2-3 天收获细胞。
化学品、抗体和 siRNA 寡核苷酸
针对 ?-tubulin (Cell Signaling)、?-tubulin (Sigma)、Drp1 (BD Biosciences)、KEAP1 (Proteintech)、Lamin B1 (Abcam)、PARP (Cell Signaling)、PMP70 (Abcam) 和 Tom20 (BD Biosciences) 的抗体) 以 1:1000 的稀释度用于蛋白质印迹和免疫荧光。 在内部,抗 Nrf2 兔抗体以 1:2000 的比例用于蛋白质印迹 [34]、[59]。 萝卜硫素 (Sigma) 和星形孢菌素 (Tocris) 分别以 50 µM 和 1 µM 使用。 除非另有说明,否则针对 Drp1 (Dharmacon)、Nrf2 (Dharmacon)、KEAP1 (Cell Signaling) 和 Bcl-XL (Cell Signaling) 的 siRNA 以 10 nM 使用。
免疫荧光和体内标记
用载体或药物处理接种在 18 mm 玻璃盖玻片上的细胞,固定在 3.7% 甲醛中,然后在冰上用 0.2% Triton X-100/PBS 渗透 10 分钟。 一抗在 3 °C 下在 PBS 中的 4% 牛血清白蛋白 (BSA) 中孵育过夜。 PBS 洗涤后,将细胞在 1% BSA/PBS 中的 Alexa488- 或 Alexa546- 偶联二抗(稀释 1:1000)和 0.1 μg/mL DAPI (Sigma) 中孵育 3 小时。 在固定前,通过抗 Tom20 免疫荧光或通过在无血清 DMEM 中的 200 nM MitoTracker Red CMXRos (Molecular Probes, Inc.) 中孵育细胞 30 分钟来观察线粒体。
显微镜和图像分析
在 LSM710 共聚焦显微镜 (Carl Zeiss) 上观察免疫荧光样品。 使用 63X 或 100X 油浸物镜捕获显微照片,并使用 Adobe Photoshop CS6 调整和增强图像。 使用 Carl Zeiss LSM710 共定位功能进行共定位分析,手动设置阈值,同时对样本的身份视而不见。 除非另有说明,否则整个比例尺均为 10 微米。 通过盲评分法评估线粒体形态。 如果一个细胞的线粒体保持为多个、圆形、可区分的斑点,则该细胞被评为“裂变”。 如果单个线粒体无法区分并且整个线粒体网络看起来是连续的,则将细胞评分为“融合”。 所有其他细胞,包括那些具有聚集线粒体的细胞,都被评为“中等”。
亚细胞分离
RPE-1 细胞生长至汇合。 PBS 洗涤后,将细胞在 600 µg 下离心 10 分钟,然后重新悬浮在 600 ?L 隔离缓冲液(210 mM 甘露醇、70 mM 蔗糖、5 mM MOPS、1 mM EDTA pH 7.4+1 mM PMSF)中。 悬浮液在 Dounce 匀浆器中裂解 30 次。 一部分匀浆被保存为“全细胞裂解物”。剩余部分在 800g 下离心 10 分钟以沉淀细胞核。 将上清液以 1500 g 离心 10 分钟以清除剩余的细胞核和未裂解的细胞。 将该上清液以 15,000 g 离心 15 分钟以沉淀线粒体。 上清液作为“细胞溶质部分”保存。 用 PBS 轻轻洗涤沉淀并重新悬浮在隔离缓冲液中。 通过二辛可宁酸 (BCA) 测定法测量每个级分的蛋白质浓度,并通过 SDS-PAGE 分离等量的蛋白质。
Western Blotting
将细胞在 PBS 中洗涤并溶解在 2 倍浓缩的 Laemmli 增溶缓冲液(100 mM Tris [pH 6.8]、2% SDS、0.008% 溴酚蓝、2% 2-巯基乙醇、26.3% 甘油和 0.001% Pyrinin Y)中。 将裂解物煮沸 5 分钟,然后加载到十二烷基硫酸钠 (SDS) 聚丙烯酰胺凝胶上。 将蛋白质转移到硝酸纤维素膜上,并将膜在 1% Milk/TBST 中封闭 5 小时。 一抗在 5% Milk/TBST 中稀释,并在 4 °C 下与印迹一起孵育过夜。 辣根过氧化物酶 (HRP) 偶联的二抗在 5% 牛奶/TBST 中稀释。 用增强的化学发光处理印迹,并使用 ImageJ 软件进行光密度定量。
萝卜硫素是从十字花科蔬菜(包括西兰花、卷心菜、花椰菜、羽衣甘蓝和羽衣甘蓝等)中提取的有机硫物质的异硫氰酸酯集合中的一种化学物质。 当黑芥子酶将萝卜硫素(一种硫代葡萄糖苷)转化为萝卜硫素(也称为萝卜硫素-硫代葡萄糖苷)时,就会产生萝卜硫素。 西兰花芽和花椰菜含有最高浓度的萝卜硫素或萝卜硫素的前体。 研究表明,萝卜硫素可增强人体的抗氧化能力,以预防各种健康问题。 CCST Insight的Alex Jimenez博士
萝卜硫素及其对癌症,死亡率,衰老,大脑和行为,心脏病等的影响
异硫氰酸盐是您可以从饮食中获得的一些最重要的植物化合物。 在本视频中,我为他们提供了迄今为止最全面的案例。 注意时间短? 通过单击以下时间点之一,跳到您喜欢的主题。 完整的时间表如下。
关键部分:
- 00:01:14 –癌症与死亡率
- 00:19:04 –老化
- 00:26:30 –大脑与行为
- 00:38:06 –最终回顾
- 00:40:27 –剂量
完整时间表:
- 00:00:34 –视频中的主要焦点萝卜硫烷的介绍。
- 00:01:14 –十字花科蔬菜的食用和全因死亡率的降低。
- 00:02:12 –前列腺癌的风险。
- 00:02:23 –膀胱癌的风险。
- 00:02:34 –吸烟者罹患肺癌的风险。
- 00:02:48 –患乳腺癌的风险。
- 00:03:13 –假设:如果您已经患有癌症该怎么办? (介入式)
- 00:03:35 –驱动癌症和死亡率相关数据的合理机制。
- 00:04:38 –萝卜硫素和癌症。
- 00:05:32 –动物证据显示西兰花芽提取物对大鼠膀胱肿瘤的发展具有很强的作用。
- 00:06:06 –直接补充萝卜硫烷对前列腺癌患者的影响。
- 00:07:09 –实际乳腺组织中异硫氰酸酯代谢物的生物富集。
- 00:08:32 –抑制乳腺癌干细胞。
- 00:08:53 –历史课:芸苔属被认为具有健康特性,即使在古罗马也是如此。
- 00:09:16 –萝卜硫素增强致癌物质(苯,丙烯醛)排泄的能力。
- 00:09:51 – NRF2是通过抗氧化反应元件进行的遗传开关。
- 00:10:10 – NRF2激活如何通过谷胱甘肽-S-结合物增强致癌物排泄。
- 00:10:34 –抱子甘蓝增加了谷胱甘肽-S-转移酶并减少了DNA损伤。
- 00:11:20 –西兰花芽菜饮料使苯的排泄量增加了61%。
- 00:13:31 –西兰花芽苗匀浆可增加上呼吸道的抗氧化酶。
- 00:15:45 –十字花科蔬菜的食用和心脏病的死亡率。
- 00:16:55 –西兰花芽粉可改善2型糖尿病患者的血脂和心脏病风险。
- 00:19:04 –老化部分的开始。
- 00:19:21 –富含萝卜硫素的饮食可将甲虫的寿命从15%延长至30%(在某些条件下)。
- 时间00:20:34 –低炎症对于延年益寿的重要性。
- 时间00:22:05 –十字花科蔬菜和西兰花芽粉似乎可以减少人类的各种炎症标记。
- 00:23:40 –视频中段回顾:癌症,老龄化部分
- 00:24:14 –小鼠研究表明,萝卜硫烷可能会改善老年患者的适应性免疫功能。
- 时间00:25:18 –萝卜硫素改善了秃顶小鼠模型的毛发生长。 图片在00:26:10。
- 00:26:30 –大脑和行为部分的开始。
- 00:27:18 –西兰花芽提取物对自闭症的影响。
- 时间00:27:48 –葡萄糖尿素对精神分裂症的影响。
- 时间00:28:17 –开始讨论抑郁症(可能的机制和研究)。
- 00:31:21 –使用10种不同的压力诱发抑郁模型进行的小鼠研究显示,萝卜硫烷与氟西汀(百忧解)的疗效相似。
- 00:32:00 –研究表明,直接摄入小鼠中的葡甘露聚糖同样可以有效地预防社交失衡应激模型引起的抑郁症。
- 00:33:01 –神经变性部分开始。
- 00:33:30 –萝卜硫素和阿尔茨海默氏病。
- 00:33:44 –萝卜硫素和帕金森氏病。
- 时间00:33:51 –萝卜硫素和亨廷顿氏病。
- 时间00:34:13 –萝卜硫素增加热休克蛋白。
- 时间00:34:43 –脑外伤部分开始。
- 00:35:01 – TBI后立即注射萝卜硫素可改善记忆力(小鼠研究)。
- 00:35:55 –萝卜硫烷和神经元可塑性。
- 00:36:32 –萝卜硫素改善了II型糖尿病小鼠的学习。
- 时间00:37:19 –萝卜硫素和杜氏肌营养不良症。
- 00:37:44 –肌肉卫星细胞中的Myostatin抑制(体外)。
- 00:38:06 –后期录像回顾:死亡率和癌症,DNA损伤,氧化应激和炎症,苯排泄,心血管疾病,II型糖尿病,对大脑的影响(抑郁,自闭症,精神分裂症,神经退行性变),NRF2途径。
- 时间00:40:27 –关于计算出西兰花芽或萝卜硫素剂量的想法。
- 00:41:01 –在家发芽的轶事。
- 00:43:14 –关于烹饪温度和萝卜硫素活性。
- 时间00:43:45 –肠道细菌从葡糖萝卜素转化为萝卜硫素。
- 时间00:44:24 –补充剂与蔬菜中的活性黑芥子酶结合使用时效果更好。
- 时间00:44:56 –烹饪技巧和十字花科蔬菜。
- 00:46:06 –异硫氰酸酯作为甲状腺激素。
致谢
Sciencedirect.com/science/article/pii/S2213231716302750
萝卜硫素是如何生产的?
加热会降低花椰菜中的 Epithiospecifier 蛋白活性并增加萝卜硫素的形成
抽象
萝卜硫素是一种来自西兰花的异硫氰酸酯,是最有效的食物衍生抗癌剂之一。 这种化合物不存在于完整的蔬菜中,而是在西兰花组织被压碎或咀嚼时,通过黑芥子酶(一种硫葡糖苷酶)的作用,由其硫代葡萄糖苷前体萝卜硫苷形成。 然而,许多研究表明,萝卜硫素的萝卜硫素产量很低,当植物组织在室温下被压碎时,一种非生物活性的腈类似物萝卜硫素是主要的水解产物。 最近的证据表明,在拟南芥中,硫代葡萄糖苷的腈形成受热敏蛋白、表硫特异性蛋白 (ESP)、黑芥子酶的非催化辅助因子控制。 我们的目标是检查加热西兰花小花和芽对萝卜硫素和萝卜硫素腈形成的影响,以确定西兰花是否含有 ESP 活性,然后关联 ESP 活性、萝卜硫素含量和生物活性的热依赖性变化,如通过诱导细胞培养中的 II 期解毒酶醌还原酶 (QR)。 在均质化之前将新鲜的西兰花小花或西兰花芽加热到 60 °C,同时增加了萝卜硫素的形成并减少了萝卜硫素腈的形成。 ESP 活性的显着丧失与萝卜硫素腈形成的减少平行。 加热到 70 °C 及以上可减少西兰花小花中两种产物的形成,但西兰花芽中没有。 在培养的小鼠肝癌 Hepa lclc7 细胞中 QR 的诱导与萝卜硫素形成的增加平行。
将西兰花小花和芽苗预热至 60 °C 显着增加了粉碎后植物组织提取物中黑芥子酶催化的萝卜硫素 (SF) 的形成。 这与萝卜硫素腈 (SF Nitrile) 形成和表硫特异性蛋白 (ESP) 活性的降低有关。
关键词: 西兰花、甘蓝、十字花科、癌症、抗癌剂、萝卜硫素、萝卜硫素腈、Epithiospecifier 蛋白、醌还原酶
总之,萝卜硫素是一种存在于西兰花和其他十字花科蔬菜中的植物化学物质。 由内部和外部因素引起的不受控制的氧化剂量会导致人体氧化应激,最终可能导致各种健康问题。 萝卜硫素可以激活 Nrf2 的产生,NrfXNUMX 是一种转录因子,有助于调节控制细胞对氧化剂反应的保护性抗氧化机制。 我们的信息范围仅限于脊椎按摩疗法和脊柱健康问题。 要讨论主题,请随时询问 Jimenez 博士或通过以下方式联系我们。915-850-0900 。
由Alex Jimenez博士策划
引用自: 科学网
附加主题讨论:急性腰痛
背疼�是全球范围内最常见的残疾和误工原因之一。 背痛是就诊的第二大常见原因,仅次于上呼吸道感染。 大约 80% 的人一生中至少会经历一次背痛。 脊柱是由骨骼、关节、韧带和肌肉以及其他软组织组成的复杂结构。 因此,受伤和/或病情加重,例如。椎间盘突出,最终会导致背部疼痛的症状。 运动伤害或汽车事故伤害通常是造成背痛的最常见原因,但是,有时最简单的动作可能会产生痛苦的结果。 幸运的是,诸如脊椎治疗等替代疗法可以通过使用脊柱调节和手动操作来帮助缓解背部疼痛,最终改善疼痛缓解。
***